Kyselina ethylendiamin-N,N'-dijantarová
| Kyselina ethylendiamin-N,N'-dijantarová | |
|---|---|
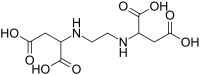 Strukturní vzorec | |
| Obecné | |
| Systematický název | kyselina 2-[2-(1,2-dikarboxyethylamino)ethylamino]butandiová |
| Sumární vzorec | C10H16N2O8 |
| Identifikace | |
| Registrační číslo CAS | 186459-75-6 |
| PubChem | 123395 |
| SMILES | C(CNC(CC(=O)O)C(=O)O)NC(CC(=O)O)C(=O)O |
| InChI | InChI=1S/C10H16N2O8/c13-7(14)3-5(9(17)18)11-1-2-12-6(10(19)20)4-8(15)16/h5-6,11-12H,1-4H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20) |
| Vlastnosti | |
| Molární hmotnost | 292,24 g/mol |
| Teplota tání | 220 °C (493 K |
| Hustota | 1,44 g/cm3 |
| Disociační konstanta pKa | 2,4 |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −1,95 MJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −4,27 MJ/mol |
Některá data mohou pocházet z datové položky. | |
Kyselina ethylendiamin-N,N'-dijantarová (EDDS) je organická sloučenina patřící mezi aminopolykarboxylové kyseliny. Používá se jako chelatační činidlo, které lze použít jako biologicky rozložitelnou náhražku kyseliny ethylendiamintetraoctové.
Struktura a vlastnosti
[editovat | editovat zdroj]EDDS má dvě chirální centra, a vytváří tak tři stereoizomery;[1] enantiomery (R,R) a (S,S) a nechirální meso izomer (R,S) isomer. Jako náhražka kyseliny ethylendiamintetraoctové se používá pouze (S,S)-izomer, protože (R,S) a (R,R) se hůře rozkládají.[2]
Příprava a výroba
[editovat | editovat zdroj]Tato sloučenina byla poprvé připravena reakcí kyseliny maleinové s ethylendiaminem.[3]
K průmyslové výrobě lze použít ethylenediamin s kyselinou fumarovou nebo maleinovou, za přítomnosti upravených mikroorganismů.[4]
Z kyseliny asparagové
[editovat | editovat zdroj](S,S)-izomer se vyrábí alkylací 1,2-dibromethanu s kyselinou L-asparagovou. Racemickou kyselinu lze získat z ethylendiaminu a kyseliny fumarové nebo maleinové.
Koordinační vlastnosti
[editovat | editovat zdroj]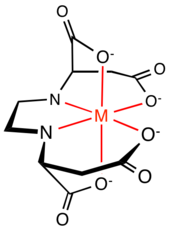
V následující tabulce jsou porovnány vlastnosti (S,S)-EDDS a EDTA při chelataci železitých iontů:
| Reakce vytvářející komplex | Rovnovážná konstanta |
|---|---|
| [Fe(H2O)6]3+ + (S,S)-EDDS4− → Fe[(S,S)-EDDS]− + 6 H2O | KEDDS = 1020,6 |
| [Fe(H2O)6]3+ + EDTA4− → Fe(EDTA)− + 6 H2O | KEDTA = 1025,1 |
Vzhledem k nižší stabilitě [Fe(S,S)-EDDS]− je vhodné rozpětí pH pro komplex (S,S)-EDDS mezi 3 a 9, zatímco u komplexu EDTA mezi 2 a 11; i tak je ale toto rozmezí použitelné ve většině případů.[5]
(S,S)-EDDS a EDTA mají také odlišnou strukturu. Šest donorových míst EDTA vytváří kolem kovového iontu pět pět pětičlenných chelátových kruhů, čtyři NC2OFe a jeden C2N2Fe kruh. C2N2Fe a dva NC2OFe kruhy vytváří rovinu, na kterou jsou dva NC2OFe kolmé, přičemž se vytváří symetrie typu C2. Pětičlenné kruhy vykazují mírné napětí. U EDDS se z šesti donorových míst vytvářejí pěti- i šestičlenné chelátové kruhy: dva NC2OFe, dva NC3OFe, a jeden C2N2Fe. Zkoumáním krystalové struktury komplexu Fe[(S,S)-EDDS]− bylo zjištěno, že dva pětičlenné NC3OFe kruhy se nachází mimo rovinu komplexu, což vede k menšímu napětí na ekvatoriálním kruhu než u Fe[EDTA]−.[6] I tento komplex je C2-symetrický.
Použití
[editovat | editovat zdroj](S,S)-EDDS má využití jako chelatační činidlo, které je náhradou kyseliny ethylendiamintetraoctové. EDTA se v přírodě přeměňuje na kyselinu ethylendiamintrioctovou a následně cyklizuje za vzniku diketopiperazinu, který se v životním prostředí hromadí.[7][8]
(S,S)-EDDS byl vyvinut jako biologicky rozložitelné chelatační činidlo a stabilizátor detergentů a kosmetických přípravků.[9]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku EDDS na anglické Wikipedii.
- ↑ J. A. Neal; N. J. Rose. Stereospecific Ligands and Their Complexes. I. A Cobalt(III) Complex of Ethylenediaminedisuccinic Acid. Inorganic Chemistry. 1968, s. 2405–2412. DOI 10.1021/ic50069a043.
- ↑ S. Tandy; A. Ammann; R. Schulin; B. Nowack. Biodegredation and speciation of residual SS-ethylenediaminedisuccinic acid (EDDS) in soil solution left after soil washing. Environmental Pollution. 2006, s. 191–199. DOI 10.1016/j.envpol.2005.10.013. PMID 16338042.
- ↑ M. Barbier, et al. Synthese und Eigenschaften eines Analogen des Lycomarasmins und der Aspergillomarasmine. Liebigs Annalen. 1963, s. 132–138. DOI 10.1002/jlac.19636680115.
- ↑ R. Takahashi, et al. Production of (S,S)-Ethylenediamine-N,N'-disuccinic Acid from Ethylenediamine and Fumaric Acid by Bacteria. Bioscience, Biotechnology, and Biochemistry. 1999, s. 1269–1273. DOI 10.1271/bbb.63.1269. PMID 27380235.
- ↑ M. Orama; H. Hyvönen; H. Saarinen; R. Aksel. Complexation of [S,S] and mixed stereoisomers of N,N'-ethylenediaminedisuccinic acid (EDDS) with Fe(III), Cu(II), Zn(II) and Mn(II) ions in aqueous solution. Journal of the Chemical Society, Dalton Transactions. 2002, s. 4644–4648. DOI 10.1039/b207777a.
- ↑ F. Pavelčík; J. Majer. The crystal and molecular structure of lithium [(S,S)-N,N'-ethylenediaminedisuccinato]cobaltate(III) trihydrate. Acta Crystallographica B. 1978, s. 3582–3585. DOI 10.1107/S0567740878011644.
- ↑ Z. Yuan; J. M. VanBriesen. The Formation of Intermediates in EDTA and NTA Biodegradation. Environmental Engineering Science. 2006, s. 533–544. DOI 10.1089/ees.2006.23.533.
- ↑ T. C. M. Yip; D. C. W. Tsang; K. T. W. Ng; I. M. C. Lo. Kinetic interactions of EDDS with soils. 1. Metal resorption and competition under EDDS deficiency. Environmental Science & Technology. 2009, s. 831–836. DOI 10.1021/es802030k. PMID 19245023. Bibcode 2009EnST...43..831Y.
- ↑ D. Schowanek; T. C. J. Feijtel; C. M. Perkins; F. A. Hartman; T. W. Federle; R. J. Larson. Biodegradation of (S,S), (R,R) and mixed stereoisomers of ethylene diamine disuccinic acid (EDDS), a transition metal chelator. Chemosphere. 1997, s. 2375–2391. DOI 10.1016/S0045-6535(97)00082-9. PMID 9192467.
