Aromatické aminokyseliny
Aromatická aminokyselina je aminokyselina obsahující aromatické jádro; z 20 základních proteinogenních aminokyselin sem patří histidin, fenylalanin, tryptofan, a tyrosin.
-
Histidin
-
Tryptofan
-
Tyrosin
-
Fenylalanin
Vlastnosti a funkce[editovat | editovat zdroj]
Optické vlastnosti[editovat | editovat zdroj]
Aromatické aminokyseliny s výjimkou histidinu absorbují ultrafialové záření od 250 nm a po vystavení němu fluoreskují, což lze využít k určení jejich koncentrací v roztoku.[1][2]
Většina bílkovin obsahuje tyrosin a tryptofan, které absorbují s maximem na 280 nm (tryptofan) a 274 nm (tyrosin).[3]
Vliv na strukturu a funkci bílkovin[editovat | editovat zdroj]
Aromatické aminokyseliny u řady bílkovin stabilizují skládané struktury.[4][5]
Aromatické zbytky se často výrazně podílejí na protein-proteinových a protein-ligandových interakcích.
Aromatické aminokyseliny jako prekurzory[editovat | editovat zdroj]
Aromatické aminokyseliny jsou častými prekurzory biomolekul.
- Z histidinu vzniká histamin.
- Z tryptofanu se vytváří 5-hydroxytryptofan, dále se přeměňující na serotonin, tryptamin, auxiny, kynureniny, nebo melatonin.[6]
- Tyrosin je prekurzorem L-3,4-dihydroxyfenylalaninu, dopaminu, noradrenalinu, adrenalinu, a hormonu thyroxinu. Také z něj vznikají oktopamin a melanin.[6]
- Z fenylalaninu se vytváří tyrosin.
Metabolismus[editovat | editovat zdroj]
Šikimátová dráha[editovat | editovat zdroj]
V rostlinách se objevuje šikimátová dráha, která nejprve vytváří chorismát, jenž je prekurzorem fenylalaninu, tyrosinu, a tryptofanu. Z těchto aminokyselin poté vznikají sekundární metabolity potřebné pro biologické funkce rostlin, jako jsou hormony kyselina salicylová a auxiny. Enzymy příslušných metabolických drah mohou být regulovány inhibitory, jež mohou zastavit tvorbu chorismátu, a tím posléze veškeré biologické funkce organismu; herbicidy a antibiotika inhibující enzymy zapojené do syntézy aromatických aminokyselin jsou tak pro rostliny toxické,[7] například glyfosát takto inhibuje 5-enolpyruvylšikimát-3-fosfátsyntázu
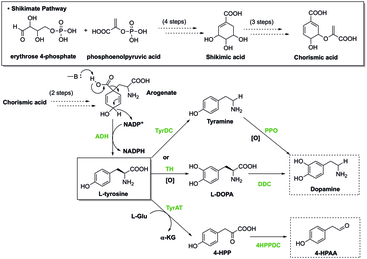
Ve výživě[editovat | editovat zdroj]
Živočichové získávají aromatické aminokyseliny z potravy, ale téměř všechny rostliny a některé mikroorganismy je vytváří metabolicky náročnou šikimátovou drahou. Histidin, fenylalanin, a tryptofan, jsou pro živočichy esenciální, zatímco tyrosin je poloesenciální: živočichové si jej mohou vytvořit, ale pouze z fenylalaninu. Fenylketonurie, geneticky podmíněný nedostatek enzymu fenylalaninhydroxylázy, způsobuje neschopnost štěpení fenylalaninu, kdy pak nedostatečný příjem tryptofanu způsobuje opoždění vývoje kostí.[8]
Nadměrný příjem aromatických aminokyselin mívá za následek vysoký krevní tlak.[9]
Aromatické stopové aminy, jako je tyramin, mohou nahradit noreadrenalin v periferálních monoaminových vezikulech a u lidí příjmajících inhibitory monoaminoxidázy vyvolat i stavy ohrožující život.
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Aromatic amino acid na anglické Wikipedii.
- ↑ Matías Möller; Ana Denicola. Protein tryptophan accessibility studied by fluorescence quenching. Biochemistry and Molecular Biology Education. 2002, s. 175–178. ISSN 1539-3429. DOI 10.1002/bmb.2002.494030030035.
- ↑ Franz-Xaver Schmid. Encyclopedia of Life Sciences. [s.l.]: John Wiley & Sons, 2001. Dostupné online. ISBN 0470016175. DOI 10.1038/npg.els.0003142. Kapitola Biological Macromolecules: UV‐visible Spectrophotometry.
- ↑ Peptide and Amino Acid Quantification Using UV Fluorescence in Synergy HT Multi-Mode Microplate Reader [online]. [cit. 2020-03-23]. Dostupné online.
- ↑ Qingping Xu, Matthew Biancalana, Joanna C. Grant, Hsiu-Ju Chiu, Lukasz Jaroszewski, Mark W. Knuth, Scott A. Lesley, Adam Godzik, Marc-André Elsliger, Ashley M. Deacon, Ian A. Wilson. Structures of single-layer β-sheet proteins evolved from β-hairpin repeats. Protein Science. 2019, s. 1676–1689. ISSN 1469-896X. DOI 10.1002/pro.3683. PMID 31306512.
- ↑ Matthew Biancalana; Koki Makabe; Shude Yan; Shohei Koide. Aromatic cluster mutations produce focal modulations of β-sheet structure. Protein Science. 2015, s. 841–849. ISSN 1469-896X. DOI 10.1002/pro.2657. PMID 25645104.
- ↑ a b Q. Han; R. S. Phillips; J. Li. Editorial: Aromatic Amino Acid Metabolism. Frontiers in Molecular Biosciences. 2019-04-10, s. 22. DOI 10.3389/fmolb.2019.00022. PMID 31024928.
- ↑ V. Tzin; G. Galili. The Biosynthetic Pathways for Shikimate and Aromatic Amino Acids in Arabidopsis thaliana. The Arabidopsis Book. 2010-05-17, s. e0132. DOI 10.1199/tab.0132. PMID 22303258.
- ↑ S. Moehn; P. B. Pencharz; R. O. Ball. Lessons learned regarding symptoms of tryptophan deficiency and excess from animal requirement studies. The Journal of Nutrition. 2012, s. 22315-22355. DOI 10.3945/jn.112.159061. PMID 23077198.
- ↑ F. Teymoori; G. Asghari; P. Mirmiran; F. Azizi. High dietary intake of aromatic amino acids increases risk of hypertension. Journal of the American Society of Hypertension. 2018, s. 25-33. DOI 10.1016/j.jash.2017.11.004. PMID 29208471.
Literatura[editovat | editovat zdroj]
- Maeda H, Dudareva N. The shikimate pathway and aromatic amino Acid biosynthesis in plants. Annual Review of Plant Biology. 2012, s. 73–105. DOI 10.1146/annurev-arplant-042811-105439. PMID 22554242.
Související články[editovat | editovat zdroj]
- Dekarboxyláza aromatických L-aminokyselin
- Rozšířený genetický kód
- Fenylketonurie
- Tyrosinhydroxyláza
- Neurotransmiter
Externí odkazy[editovat | editovat zdroj]
- Tyrosine hydroxylase deficiency [online]. U.S. National Library of Medicine, 2020. Dostupné online.




