Šťavelan železitý
| Šťavelan železitý | |
|---|---|
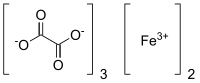 strukturní vzorec | |
| Obecné | |
| Systematický název | šťavelan železitý |
| Funkční vzorec | Fe2[(COO)2]3 |
| Sumární vzorec | C6Fe2O12 |
| Vzhled | světle žlutá pevná látka (bezvodý) zelená pevná látka (hexahydrát) |
| Identifikace | |
| Registrační číslo CAS | 2031-89-2 |
| PubChem | 168963 |
| SMILES | C(=O)(C(=O)[O-])[O-].C(=O)(C(=O)[O-])[O-].C(=O)(C(=O)[O-])[O-].[Fe+3].[Fe+3] |
| InChI | InChI=1S/3C2H2O4.2Fe/c3*3-1(4)2(5)6;;/h3*(H,3,4)(H,5,6);;/q;;;2*+3/p-6 |
| Vlastnosti | |
| Molární hmotnost | 187,87 g/mol (bezvodý) 295,97 g/mol (hexahydrát) |
| Teplota tání | 365,1 °C (636,2 K) |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H312[1] |
| P-věty | P264 P270 P280 P301+317 P302+352 P317 P321 P330 P362+364 P501[1] |
Některá data mohou pocházet z datové položky. | |
Šťavelan železitý je organická sloučenina a železitá sůl kyseliny šťavelové. Bezvodá sůl je světle žlutá, může ale vytvářet několik různých hydrátů, například hexahydrát (Fe2(C2O4)3·6H2O), které jsou zelené.
Struktura
[editovat | editovat zdroj]Tetrahydrát
[editovat | editovat zdroj]
Krystalová struktura tetrahydrátu (Fe2(C2O4)3·4H2O) byla určena v roce 2015. Sloučenina obsahuje triklinickou jednotkovou buňku tvořenou dvojicí atomů železa. Každý atom železa je navázán na kyslíkové atomy tří šťavelanových iontů a jedné molekuly vody za vzniku oktaedrické geometrie. Dva šťavelanové ionty, ležící v navzájem přibližně kolmých rovinách, jsou tetradentátní a propojují atomy železa do střídavých řetězců. Třetí šťavelan je bidentátní a spojuje atomy železa ze sousedních řetězců. Polovina molekul vody se nachází mezi těmito řetězci a není vázaná. Mössbauerovo spektrum Fe2(C2O4)3·4H2O ukazuje u železa izomerní posun 0,38 mm/s a kvadrupólové rozštěpení o hodnotě 0,40 mm/s, což naznačuje, že jde o vysokospinový oktaedrický komplex.[2]
Použití
[editovat | editovat zdroj]V zubním lékařství
[editovat | editovat zdroj]Podobně jako mnoho dalších šťavelanů byl šťavelan železitý zkoumán ohledně možného využití při krátkodobé léčbě citlivosti zubů.[3] Přidává se do některých zubních past, jeho účinnost je ale sporná.[4]
Fotografie
[editovat | editovat zdroj]Šťavelan železitý se používá jako vrstva citlivá na světlo ve fotografické technice nazývané kallitypie.
Elektrické články
[editovat | editovat zdroj]Tetrahydrát šťavelanu železitého je možné použít jako materiál na kladné elektrody lithium-železných článků. Průměrný dosahovaný potenciál je 3,35 V a kapacita činí 98 mAh/g.[2]
Organická syntéza
[editovat | editovat zdroj]Hexahydrát šťavelanu železitého se používá, ve spojení s tetrahydridoboritanem sodným, při radikálových Markovnikovovských hydrofunkcionalizacích alkenů.[5]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Ferric oxalate na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/168963
- ↑ a b Hania Ahouari, Gwenaëlle Rousse, Juan Rodríguez-Carvajal, Moulay-Tahar Sougrati, Matthieu Saubanère, Matthieu Courty, Nadir Recham, Jean-Marie Tarascon. Unraveling the Structure of Iron(III) Oxalate Tetrahydrate and Its Reversible Li Insertion Capability. Chemistry of Materials. 2015, s. 1631–1639. DOI 10.1021/cm5043149.
- ↑ D. G. Gillam; H. N. Newman; E. S. Davies; J. S. Bulman; E. S. Troullos; F. A. Curro. Clinical evaluation of ferric oxalate in relieving dentine hypersensitivity. Journal of Oral Rehabilitation. 2004, s. 245–250. DOI 10.1046/j.0305-182X.2003.01230.x. PMID 15025657.
- ↑ J. Cunha-Cruz; J. R. Stout; L. J. Heaton; J. C. Wataha. Dentin Hypersensitivity and Oxalates: a Systematic Review. Journal of Dental Research. 2010-12-29, s. 304–310. DOI 10.1177/0022034510389179. PMID 21191127.
- ↑ Timothy Barker. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2001-04-15. Dostupné online. ISBN 978-0-471-93623-7. DOI 10.1002/047084289X.rn02346. Kapitola Ferric Oxalate Hexahydrate, s. 1–4.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Šťavelan železitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Šťavelan železitý na Wikimedia Commons

