Cykloizomerace
Cykloizomerizace je označení izomerizačních reakcí, při kterých ze substrátů vznikají jejich cyklické izomery. Výhodou takových reakcí je jejich úspornost, kdy jsou v produktu přítomny všechny atomy z výchozí sloučeniny. Většina z nich je katalyzována přechodnými kovy, některé organokatalyzátory, ojediněle mohou probíhat i tepelně. Tento druh cykjlizací se mnohdy vyznačuje vysokou selektivitou a cykloizomerizace jsou tak užitečným způsobem tvorby jedinečných a složitých molekulových struktur.[1] Cykloizomerizace jsou velmi širokou skupinou. Jejich hlavními dvěma skupinami jsou vnitromolekulární varianty Michaelových adicí a Dielsových–Alderových reakcí. Z hlediska substrátů jsou nejvíce prozkoumané cykloizomerizace enynů a jim podobných alkenů.[2]
Vnitromolekulární Michaelovy adice[editovat | editovat zdroj]
Cyklické izomery necyklických sloučenin lze získat vnitromolekulárními konjugovanými adicemi na α,β–nenasycené karbonylové sloučeniny (tedy vnitromolekulárními Michaelovými adicemi). Jako Michaelovy akceptory zde mohou sloužit konjugované enony, enaly nebo nitroalkeny; jiné druhy sloučenin se takto využívají jen vzácně.[3] Přestože jde o běžně prováděné reakce, tak není známo mnoho jejich asymetrických variant.[2]
Thiomočovinové katalyzátory s chirálními postranními řetězci mohou aktivovat systémy s navázanými nitroalkanovými a esterovými skupinami a vyvolávat tak asymetrické vnitromolekulární Michaelovy adice.[3][4] Příkladem využitelnosti těchto reakcí může být příprava cyklického prekurzoru γ–aminokyseliny znázorněná na obrázku 1.[3] Aktivace pravděpodobně probíhá přes vodíkové vazby nitronátu a esteru na katalyzátor; takto lze vysvětlit i selektivitu vůči E–esteru.[3]

Stereodivergentní organokatalytické Michaelovy adice spojené s laktonizacemi je možné použít na izomerizace dihydrofuranů a tetrahydrofuranů v rámci syntéz řady přírodních látek (viz obrázek 2).[5] Ethery, jako je 3, za přítomnosti (S)–(–)–tetramisolhydrochloridu (4) vytvářejí syn–2,3–substituované tetrahydrofurany; odpovídající anti–produkty je možné připravit pomocí katalyzátorů založených na chinovníkových alkaloidech, jako je 7.[5]

Vnitromolekulární Dielsovy–Alderovy reakce[editovat | editovat zdroj]
Vnitromolekulární Dielsovy–Alderovy reakce spojují dieny a dienofily prostřednictvím [4+2] adicí, což je nejčastější druh koncové substituce. Jsou častými součástmi totálních syntéz a mají využití v přípravách mnoha synteticky obtížných struktur.[6] Příkladem může být enantioselektivní přeměna v rámci asymetrické syntézy toxinu (–)–isopulo’uponu (10).[7]

Syntetickou využitelnost těchto reakcí lze ukázat na přípravě (–)– isopulo’uponu katalyzované kationtovým Cu2+bis(oxazolin)ovým komplexem; produkt byl bicycklický a obsahoval čtyři stereocentra (viz obrázek 3).[7] Dalším příkladem může být tvorba tricyklického jádra palhininových alkaloidů.[8]
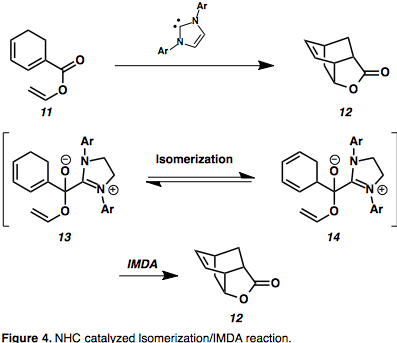
N–heterocyklické karbeny jsou organokatalyzátory schopnými způsobovat obrácení polarity, kvůli omezenému spektru substrátů však nejsou používány příliš často.[9] Mohou být zapojeny například do kaskádových isomerizací alkenů s Dielsovými-Alderovými reakcemi za vzniku bicyklických řetězců.[10][11] Dienylestery, jako 11, lze převést na substituované bicyklo[2.2.2]oktany izomerizaci za stabilizace azolium-poloacetalovými meziprodukty (13).[11] Aktivační bariéra izomerizace hexa-1,3–dienu [1,5]–přesmykem činí přibližně 170 kJ/mol a při konjugaci esteru se zvyšuje, takže nekatalyzovaná izomerizace je nepravděpodobná.[11] Tímto způsobem lze obejít vysokou aktivační bariéru, což umožňuje vytvářet dříve nedostupné sloučeniny.
Cykloizomerizace enynů[editovat | editovat zdroj]
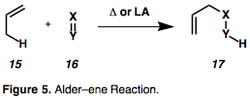
1,n-Enyny se na příslušné cyklické izomery přeměňují Alder-enovými reakcemi (viz obrázek 5).
Přestože může být přesmyk spouštěn tepelně, tak je v takovém případě kvůli vysokým reakčním teplotám omezený rozsah substrátů, často se tak používají katalyzátory založené na přechodných kovech, jako jsou Au, Pd, Pt, Rh a Ir.[2] Tímto způsobem je možné tvořit karbo– a heterocyklické řetězce s velmi dobrými chemo–, regio– a diastereoselektivitami.[2]
Cykloizomerizace enynů nelze popsat jediným mechanismem, protože je mechanismus závislý na podmínkách reakce a použitém katalyzátoru.[2][12] Meziprodukty kovy katalyzovaných cykloizomerizací jsou zobrazeny na následujícím obrázku:
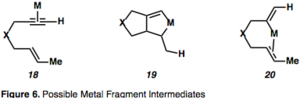
Aktivace alkynu komplexací s kovem vede k η2–kovovému meziproduktu, jako je například 18, který aktivuje alkyn vůči nukleofilním atakům a vyvolává tak tvorbu karbokationtů; tato reakce je důležitá pro pochopení reakcí řízených π–kyselinami. Komplexace alkynu s kovem posune elektronovou hustotu vazby a její zpětné dodávání kovem způsobí pozorovanou elektrofilitu a následnou nukleofilitu vicinálního uhlíkového atomu alkynu.
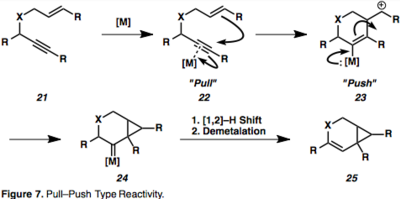
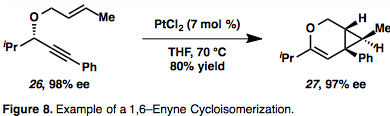
Metalocyklické meziprodukty (19) jsou důsledky současného průběhu komplexace a aktivace obou reaktantů. Hydrometalace alkynu utvoří vinylkovovou sloučeninu, která poté karbometaluje alken (20). Příklad cykloizomerizace 1,6–enynu probíhající přes η2–aktivovaný kovový meziprodukt je znázorněn na obrázku 8;[13] tento druh meziproduktu je u cykloizomerizací enynů řízených Pt nebo Au díky jejich π–kyselosti častý. V tomto případě dochází k přesunu chirality, kdy absolutní stereochemie enynu (26) určuje stereochemii produktu (27).[13]
Izomerizace enynů řízené Au a Pt[editovat | editovat zdroj]
Aktivace alkynů π–kyselými kovy, jako jsou Au a Pt je častým způsobem vytváření složitých organických struktur, přesný průběh reakcí ale není znám a mechanismus je navržen především na základě výsledků reakcí a teoretických výpočtů.[14][15] Nejobvykleji se zde používají kationtové zlatné a platnaté katalyzátory, které vykazují silnou Lewisovskou kyselost a mohou stabilizovat kationtové meziprodukty.[16]
Cykloizomerizace enynů katalyzované zlatnými sloučeninami mají využití v asymetrických syntézách kruhů střední velikosti, které se pro určitou danou strukturu molekuly vytvářejí obtížně. Sedmi a osmičlenné asymetrické karbocykly se dají vytvářet pomocí chirálních BINAP-zlatných katalyzátorů, které umožňují vytvářet řadu různých sloučenin.[17]
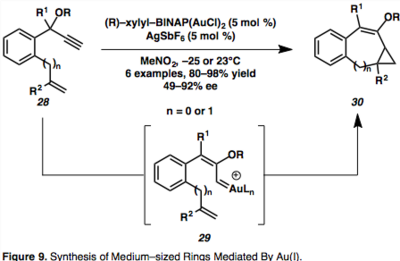
Podle navrženého mechanismu vnitromolekulární cyklopropanace probíhají skrz 1,2–přesmyky propargylesterů řízené Au za vzniku syn–Au-vinylkarbenoidů (29).[17] Výpočetní studie ukázaly, že při kinetickém řízení reakce vzniká syn–meziprodukt, 29, který se vyskytuje v rovnováze s termodynamicky výhodným cis–meziproduktem, který vytváří reakcí s nukleofilem vinylcyklopropandienovou sloučeninu.[17]
I vinylcykloalkeny mohou být připraveny alkynovými aktivacemi enynů π–kyselými kovy. PtCl2 katalyzuje tvorbu několika exotických vinylcykloalkenů ze snadno dostupných výchozích látek (viz obrázek 10).[18]

U enynů s cykloalkenovými skupinami dochází k rozšiřování kruhů formálními insercemi methylenových skupin alkenů mezi dva uhlíky alkynové skupiny; bylo i navrženo mechanistické vysvětlení tohoto jevu.[19] Tvorba těchto vinycykloalkenů a rozšiřování kruhu bylo využito při syntéze sloučeniny 36, meziproduktu totální syntézy streptorubinu B.[18] Podobnou přeměnu lze uskutečnit pomocí kationtových zlatných komplexů, ovšem zde lze vytvořit jak vinycykloalkeny mechanismem zahrnujícím 5–exo–reakci, tak i bicyklopropany 6–endo–reakcí.[20] Na základě výpočtů pomocí teorie funkcionálu hustoty se předpokládá, že u zlatných komplexů převažuje 5–exo–cyklizace, protože má nižší aktivační bariéru než 6–endo–varianta a tímto způsobem bylo připraveno mnoho různých vinylcykloalkenů (viz obrázek 11).

Reaktivitu lze otočit změnou reakčních podmínek, katalyzátoru a substrátu.[20] Divergentní reaktivita je zde dalším důvodem jejich syntetické užitečnosti.
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Cycloisomerization na anglické Wikipedii.
- ↑ Enantioselective, transition metal catalyzed cycloisomerizations Angela Marinetti, Hélène Jullien and Arnaud Voituriez Chemical Society Reviews, 2012,41, 4884-4908 DOI:10.1039/C2CS35020C, Critical Review
- ↑ a b c d e Watson, I. D. G.; Toste, F. D. Chemical Science 2012, 3, 2899–2919
- ↑ a b c d Nodes, W. J.; Nutt, D. R.; Chippindale, A. M.; Cobb, A. J. A. Journal of the American Chemical Society 2009, 131, 16016–16017
- ↑ Zhang, Z.; Schreiner, P. R. Chemical Society Reviews 2009, 38, 1187–1198
- ↑ a b Belmessieri, D.; Houpliere, A.; Calder, E. D. D.; Taylor, J. E.; Smith, A. D. Chemistry—A European Journal 2014, 20, 9762–9769
- ↑ Takao, K; Munakata, R.; Tadano, K. Chemical Reviews 2005, 105, 4779–4807
- ↑ a b Johnson, J. S.; Evan, D. A. J. Organic Chemistry 1997, 62, 786–787.
- ↑ Sizemore, N.; Rychnovsky, S. D. Organic Letters 2014, 16, 688–691.
- ↑ Izquierdo, J. Hutson, G. E.; Cohen, D. T.; Scheidt, K. Angewandte Chemie International Edition 2012, 51, 11686–11698
- ↑ Grossman, A.; Enders, D. Angewandte Chemie International Edition 2012, 51, 314–325.
- ↑ a b c Kowalczyk, M.; Lupton, D. W. Angewandte Chemie International Edition 2014, 53, 5314–5317.
- ↑ Genêt, J. –P.; Toullec, P. Y.; Michelet, V. Angewandte Chemie International Edition 2008, 47, 4268–4315
- ↑ a b Newcomb, E. T.; Ferreira, E. M. Organic Letters 2013, 15, 1772–1775
- ↑ Fürstner, A.; Davies, P. W. Angewandte Chemie Inernational Edition 2007, 46, 3410–3449
- ↑ Jiménez–Núñez, E.; Echavarren, A. M. Chemical Reviews 2008, 108, 3326–3350
- ↑ Gorin, D. J.; Toste, F. D. Nature 2007, 446, 395–403.
- ↑ a b c Watson, I. D. G.; Ritter, S; Toste, F. D. Journal of the American Chemical Society 2009, 131, 2056–2057
- ↑ a b Fürstner, A.; Stelzer, F.; Szillat, H. Journal of the American Chemical Society 2001, 123, 11863–11869
- ↑ Zhang, L.; Sun, J.; Kozmin, S. A. Advanced Synthesis & Catalysis 2006, 348, 2271–2296
- ↑ a b Nieto–Oberhuber, C.; Muñoz, M. P.; Buñel, E.; Nevado, C.; Cμrdenas, D. J.; Echavarren, A. M. Angewandte Chemie International Edition 2004, 43, 2402–2406
