Adiabatický děj
Adiabatický děj je termodynamický děj, při kterém nedochází k tepelné výměně mezi soustavou a okolím. Děj probíhá při dokonalé tepelné izolaci, takže soustava žádné teplo nepřijímá ani nevydává. Za adiabatický lze pokládat takový děj, který proběhne tak rychle, že se výměna tepla s okolím nestačí uskutečnit.
Ideální plyn
[editovat | editovat zdroj]Při vratném adiabatickém ději v ideálním plynu platí
- ,
kde je tlak plynu, je objem plynu a je Poissonova konstanta. Tento vztah bývá někdy označován jako Poissonův zákon.
Odvození
[editovat | editovat zdroj]Protože při adiabatickém ději nedochází k výměně tepla s okolím, bude . Podle prvního termodynamického zákona pak dostaneme vztah
To lze interpretovat tak, že při adiabatickém stlačování () plyn práci přijímá a dochází tak ke zvětšování vnitřní energie (), čímž se plyn ohřívá. Při rozpínání () plyn naopak koná práci na úkor vnitřní energie (), čímž se ochlazuje. Změna vnitřní energie je tedy rovna práci vykonané okolím na systému.
Podle stavové rovnice ideálního plynu (její diferenciál je ) lze psát
Využitím Mayerova vztahu a po vydělení dostaneme
S využitím Poissonovy konstanty lze předchozí vztah zapsat jako
odkud po integraci dostaneme
a po odlogaritmování lze psát
- .
Při tomto ději se tedy zachovává jistá veličina, která je funkcí entropie (jak ukáže podrobnější rozbor).
Adiabata
[editovat | editovat zdroj]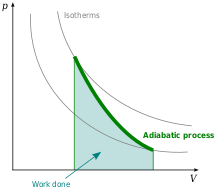
Závislost tlaku na objemu při adiabatickém ději je v p-V diagramu klesající mocninná křivka zvaná adiabata. Poněvadž , klesá adiabata (z daného stejného počátečního stavu) rychleji než izoterma. V tepelném (T-S) diagramu je adiabata část přímky.
Vlastnosti
[editovat | editovat zdroj]Při adiabatickém ději se práce koná na úkor vnitřní energie. Pro práci vykonanou okolím na ideální plyn tedy bude platit
Z Mayerova vztahu a s pomocí Poissonovy konstanty lze práci vyjádřit ve tvaru
Z této rovnice je možné s pomocí stavové rovnice vyloučit teplotu, tzn. , čímž dostaneme
Pro entropii při vratném adiabatickém ději platí
Při vratném adiabatickém ději se tedy entropie nemění. Děje, při nichž se nemění entropie, bývají označovány jako iz(o)entropické.
Na rozdíl od izotermického děje je pro průběh adiabatického děje třeba zajistit dokonalou tepelnou izolaci. Reálné děje nejsou ani přesně izotermické. Lepším přiblížením reálných dějů jsou procesy polytropické.
Při adiabatické volné expanzi ideálního plynu se teplota mezi počátečním a koncovým stavem nezmění. Plyne to z Gay - Lussacova pokusu.
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu adiabatický děj na Wikimedia Commons
Obrázky, zvuky či videa k tématu adiabatický děj na Wikimedia Commons  Encyklopedické heslo Adiabatické křivky v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Adiabatické křivky v Ottově slovníku naučném ve Wikizdrojích























