Acetylendiol
| Acetylendiol | |
|---|---|
Strukturní vzorec | |
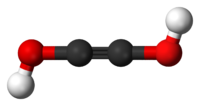 Model molekuly | |
| Obecné | |
| Systematický název | ethyndiol |
| Funkční vzorec | HOC≡COH |
| Sumární vzorec | C2H2O2 |
| Identifikace | |
| Registrační číslo CAS | 16005-17-7 |
| PubChem | 9942115 |
| SMILES | C(#CO)O |
| InChI | 1S/C2H2O2/c3-1-2-4/h3-4H |
| Vlastnosti | |
| Molární hmotnost | 58,036 g/mol |
Některá data mohou pocházet z datové položky. | |
Acetylendiol (systematicky ethyndiol) je organická sloučenina se vzorcem HO−C≡C−OH; jedná se o diol odvozený od ethynu (acetylenu), látka tak patří mezi alkynoly. Je nestabilní a přeměňuje se na svůj tautomer glyoxal, (CHO)2.
Detekce[editovat | editovat zdroj]
Acetylendiol lze pozorovat v plynné fázi pomocí hmotnostní spektrometrie.[1] Získat jej lze fotolýzou kyseliny kvadrátové v matrici z pevného argonu při 10 K (-263 °C).[2]
Deriváty[editovat | editovat zdroj]
Alkoxidy[editovat | editovat zdroj]
Stejně jako diol je i většina jeho etherů nestálá; di-terc-butoxyacetylen ale lze izolovat pomocí destilace.
Acetylendioláty[editovat | editovat zdroj]
Acetylendiol vytváří acetylendiolátový (ethyndiolátový) anion, −O−C≡C−O−, a příslušné soli. Tyto soli se nepřipravují z ethyndiolu, ale redukcí oxidu uhelnatého. Acetylendiolát draselný (K2C2O2) získal poprvé Justus von Liebig v roce 1834, a to reakcí oxidu uhelnatého s draslíkem,[3] předpokládal ale, že jde o „karbonyl draslíku“ (KCO). Během příštích 130 let byly popsány „karbonyly“ sodíku (1893), barya (1903), stroncia (1906) a lithia, rubidia a cesia (1933).[4] Poté se ukázalo, že původní reakcí vzniká směs acetylendiolátu draselného a benzenhexolátu draselného (K6C6O6).[5]
Struktura těchto solí byla zjištěna v roce 1963.[6][7]
Acetylendioláty je možné vytvořit také rekcemi CO a roztoků příslušných kovů v kapalném amoniaku.[4] Acetylendiolát draselný je světle žlutá pevná látka, která explozivně reaguje se vzduchem, halogeny, halogenovanými uhlovodíky, alkoholy,vodou a jinými sloučeninami obsahujícími kyselé vodíky.[8]
Komplexy[editovat | editovat zdroj]
Acetylendiol může vytvářet komplexní sloučeniny, například [TaH(HOC≡COH)(dmpe)2Cl]+Cl−.[9]
Acetylendiolát a jiné podobné anionty, jako jsou deltát (C3O 2-
3 ) a squarát (C4O 2-
4 ) lze připravit z oxidu uhelnatého za mírných podmínek redukčním párováním CO ligandů v organických komplexech uranu.[10]
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Acetylenediol na anglické Wikipedii.
- ↑ Johan K. Terlouw; Peter C. Burgers; Ben L. M. van Baar; Thomas Weiske; Helmut Schwarz. The Formation in the Gas Phase of HO–CC–OH, H2N–CC–NH2, H2N–CC–OH and Related Compounds by Selective Reduction of Their Cations. Chimia. 1986, s. 357–359. Dostupné online.
- ↑ Günther Maier; Christine Rohr. Ethynediol: Photochemical generation and matrix-spectroscopic identification. Liebigs Annalen. 1996, s. 307–309. DOI 10.1002/jlac.199619960303.
- ↑ Justus Liebig (1834), Annalen der Chemie und Pharmacie, volume 11, p. 182
- ↑ a b T. G. Pearson (1933), Carbonyls of Lithium, Rubidium and Caesium, Nature, volume 131, pp. 166–167 DOI:10.1038/131166b0
- ↑ Werner Büchner, E. Weiss (1964) Zur Kenntnis der sogenannten «Alkalicarbonyle» IV[1] Über die Reaktion von geschmolzenem Kalium mit Kohlenmonoxid. Helvetica Chimica Acta, Volume 47 Issue 6, Pages 1415–1423DOI:10.1002/hlca.19640470604
- ↑ Werner Büchner, E. Weiss (1963) Zur Kenntnis der sogenannten «Alkalicarbonyle» I Die Kristallstruktur des Kalium-acetylendiolats, KOC≡COK. Helvetica Chimica Acta, Volume 46 Issue 4, Pages 1121–1127 DOI:10.1002/hlca.19630460404
- ↑ E. Weiss, Werner Büchner (1963), Zur Kenntnis der sogenannten Alkalicarbonyle. II. Die Kristallstrukturen des Rubidium- und Caesium-acetylendiolats, RbOC≡CORb und CsOC≡COCs. Zeitschrift für anorganische und allgemeine Chemie, Volume 330 Issue 5-6, Pages 251–258 DOI:10.1002/zaac.19643300504
- ↑ Charles Kenneth Taylor (1982), The Chemical Behavior of the Alkali Metal Acetylenediolates. Thesis, Pennsylvania State University; also Technical Memo A642321, Penn State University Park Applied Research Lab. 227 pages
- ↑ Raymond N. Vrtis, Ch. Pulla Rao, Simon G. Bott, and Stephen J. Lippard (1988), Synthesis and Stabilization of Tantalum-Coordinated Dihydroxyacetylene from Two Reductively Coupled Carbon Monoxide Ligands Journal of the American Chemical Society, volume 110 issue 22, pp. 7564–7566 DOI:10.1021/ja00230a062
- ↑ Alistair S. Frey, F. Geoffrey N. Cloke, Peter B. Hitchcock (2008), Mechanistic Studies on the Reductive Cyclooligomerisation of CO by U(III) Mixed Sandwich Complexes; the Molecular Structure of [(U(η-C8H6{Si'Pr3-1,4}2)(η-Cp*)]2(μ-η1:η1-C2O2) Journal of the American Chemical Society, volume 130, issue 42, pages 13816–13817 DOI:10.1021/ja8059792
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Acetylendiol na Wikimedia Commons
Obrázky, zvuky či videa k tématu Acetylendiol na Wikimedia Commons
