Sulfamid
Vzhled
| Sulfamid | |
|---|---|
 | |
| Obecné | |
| Sumární vzorec | H₄N₂O₂S |
| Identifikace | |
| Registrační číslo CAS | 7803-58-9 |
| Vlastnosti | |
| Molární hmotnost | 95,999 Da |
| Bezpečnost | |
| [1] Varování[1] | |
Některá data mohou pocházet z datové položky. | |
Sulfamid (diamid kyseliny sírové, také amid sulfurylu) je anorganická sloučenina se vzorcem H2NSO2NH2. Vyrábí se reakcí sulfurylchloridu s amoniakem.
Sulfamidová funkční skupina
[editovat | editovat zdroj]V organické chemii se jako sulfamid označuje také funkční skupina, sestávající z nejméně jedné organické skupiny navázané na atom dusíku sulfamidu.
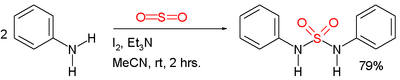
Symetrické sulfamidy lze připravovat přímo z aminů a plynného oxidu siřičitého[2]:
Zde jsou reaktanty anilin, triethylamin a jod. Oxid siřičitý se zřejmě aktivuje sérií meziproduktů: Et3N-I+-I−, Et3N-I+-I3− a Et3N+-SO2−.
Sulfamidová funkční skupina se čím dál častěji strukturálně používá v lékařské chemii.[3]
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Sulfamid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sulfamid na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Sulfamide na anglické Wikipedii.
- ↑ a b Sulfamide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Sulfamides and sulfamide polymers directly from sulfur dioxide Alexander V. Leontiev, H. V. Rasika Dias and Dmitry M. Rudkevich Chem. Commun., 2006, 2887 - 2889, DOI:10.1039/b605063h
- ↑ Allen B Reitz, Garry R Smith, and Michael H Parker. The role of sulfamide derivatives in medicinal chemistry: a patent review (2006 – 2008). Expert Opinion on Therapeutic Patents. 2009, roč. 19, čís. 10, s. 1449–1453. DOI 10.1517/13543770903185920.