Organická fotochemie
Organická fotochemie je obor organické chemie a fotochemie zkoumající organické reakce spouštěné působením světla;[1][2] tyto reakce často vyvolává pohlcování ultrafialového záření organickými molekulami. V organické fotochemii se nejdříve využívalo viditelné světlo, zatímco později převládlo používání ultrafialových lamp. Organické fotochemické reakce se používají na jednoduché vytváření složitých organických molekul.
Historie
[editovat | editovat zdroj]První případy organofotochemických reakcí, které spočívaly v tvorbě sraženin nebo změnách barvy při vystavení vzorků slunečnímu světlu, nebyly často zachyceny. Prvním popsanou organofotochemickou reakcí byla přeměna santoninu na žlutou sloučeninu pomocí slunečního světla:[3]

Jedním z prvních příkladů fotochemické tvorby sraženiny byla fotodimerizace antracenu.[4] Podobně se podařilo dimerizovat kyselinu skořicovou na kyselinu truxilovou. Nyní je známo mnoho dalších fotodimerů, například pyrimidinu, thiofosgenu a diamantanu.
V roce 1956 byla provedena reakce, při které proběhla fotolýza nitroskupiny v poloze meta namísto obvyklé aktivace v polohách ortho a para.[5]

Pokrok v organické fotochemii přinesla Woodwardova–Hoffmannova pravidla.[6][7] Tato pravidla pomohla vysvětlit výsledek fotochemicky řízené elektrocyklického uzavírání kruhu hexa-2,4-dienu, které probíhá disrotačně.

Organické reakce vyhovující těmto pravidlům se označují jako symetricky povolené. Reakce probíhající opačně jsou symetricky zakázané a buď vyžadují mnohem více energie, nebo vůbec neprobíhají.
Příklady reakcí
[editovat | editovat zdroj]Organické fotochemické reakce se vysvětlují pomocí excitovaných stavů.[8][9]
Podobně jako u struktury byl zkoumán také vliv násobnosti spinových stavů - zda jde o singlety nebo triplety - na reaktivitu. Triplety mívají delší životnosti a nižší energie než singlety o stejné konfiguraci. Triplety mohou vznikat z vytvořených singletů nebo interakcemi s triplety o vyšších energiích.
K běžným organickým fotochemickým reakcím patří: Norrishovy reakce (dělené na typy I a II), racemizace opticky aktivních bifenylů, cyklohexadienonové přesmyky (mohou být typu A nebo B), di-pí-methanové přesmyky, přesmyky bicyklo[3.1.0]hexanonů na fenoly, fotochemické elektrocyklické procesy, přesmyky epoxyketonů na beta-diketony, otevírání kruhu u cyklopropylketonů, heterolýzy 3,5-dimethoxylbenzylových sloučenin, a fotochemické cyklizace dienů.
Přehled
[editovat | editovat zdroj]
Reaktanty fotochemických reakcí mohou být plynné i kapalné.[10] Zpravidla se reagující látky musí dostat do blízkosti zdroje světla, aby bylo dosaženo nejvyšší možné světelné účinnosti. Reakční směs tak může být ozářena buď přímo, nebo ze strany reaktoru.[11]
Nevýhodou fotochemických reakcí je nízká účinnost přeměny elektrické energie na energii záření o potřebné vlnové délce. Zdroj záření vydává také velké množství tepla, což způsobuje nutnost chlazení. Většina zdrojů vyzařuje polychromatické záření, potřeba je však monochromatické.[12] Tyto nevýhody jsou vyvažovány vysokým kvantovým výtěžkem.
Tyto reakce je výhodné provádět za nízkých teplot, čímž se omezí vedlejší reakce (a zlepší selektivita) a tím i výtěžnost (protože se sníží míra vypařování plynných reaktantů z roztoku).
Výchozí látky se před reakcí někdy ochladí natolik, že teplo uvolněné reakcí je absorbováno, aniž by bylo nutné reakční směs dále chladit. U plynných nebo nízkovroucích reaktantů je potřebný přetlak.
Vzhledem k velkému počtu možných výchozích látek je popsáno i mnoho různých fotochemických reakcí.[13][14]
Příklady studií
[editovat | editovat zdroj][2+2] cykloadice
[editovat | editovat zdroj]Alkeny se mohou dimerizovat působením ultrafialového záření.[15]
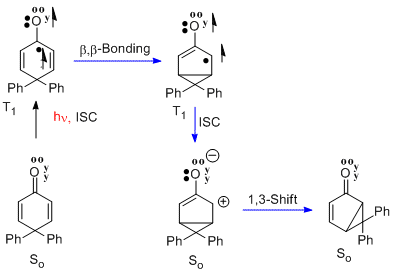
Přesmyk 4,4-difenylcyklohexadienonu
[editovat | editovat zdroj]Obdobou přeměny santoninu na lumisantonin je přesmyk 4,4-difenylcyklohexadienonu.[9] V tomto případě n-π* tripletový excitovaný stav prochází stejnou beta-beta reakcí. Následně se vytvoří singletový zwitterion v základním stavu. Posledním krokem je přesmyk, kterým vzniká bicyklická sloučenina. Reakce patří mezi cyklohexadienonové přesmyky typu A.
4,4-difenylcyklohexenon
[editovat | editovat zdroj]Přesmyk 4,4-difenylcyklohexenonu se liší od předchozích tím, že jsou k přesmykům typu A potřeba dvě dvojné vazby. Dvojná vazba na jedné z fenylových skupin, původně na C-4, se přesouvá na C-3 (tedy beta uhlík).[16]
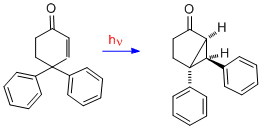
Pokud je na jeden z arylů navázána para-kyano nebo para-methoxyskupina, tak se tento aryl přesouvá přednostně.[17]Zkoumáním fenoniových sloučenin, u kterých se aryl začal přesouvat na beta-uhlík, bylo zjištěno, že za přítomnosti substituentu v poloze para zvyšuje míru delokalizace elektronů a tato reakční dráha je tak více stabilizovaná.

n-π* reaktivita
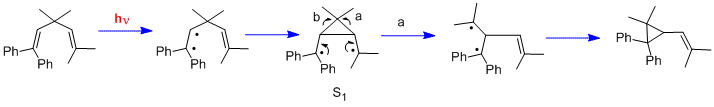
[editovat | editovat zdroj]Dalším druhem fotochemické reakce je di-pí-methanový přesmyk;[18] patří sem například přesmyky 1,1,5,5-tetrafenyl-3,3-dimethyl-penta-1,4-dienu[19] a barrelenu na semibullvalen.[20]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Organic photochemistry na anglické Wikipedii.
- ↑ P. Klán, J. Wirz Photochemistry of Organic Compounds: From Concepts to Practice. Wiley, Chichester, 2009, ISBN 978-1405190886
- ↑ N. J. Turro, V. Ramamurthy, J. C. Scaiano Modern Molecular Photochemistry of Organic Molecules Archivováno 25. 7. 2019 na Wayback Machine.. University Science Books, Sausalito, 2010, ISBN 978-1891389252
- ↑ Heinz D. Roth. The Beginnings of Organic Photochemistry. Angewandte Chemie International Edition in English. 1989, s. 1193–1207. DOI 10.1002/anie.198911931.
- ↑ Karl Elbs. Ueber Paranthracen. Journal für Praktische Chemie. 1891-06-30, s. 467–469. Dostupné online. ISSN 0021-8383. DOI 10.1002/prac.18910440140.
- ↑ E. Havinga; R. O. De Jongh; W. Dorst. Photochemical acceleration of the hydrolysis of nitrophenyl phosphates and nitrophenyl sulphates. Recueil des Travaux Chimiques des Pays-Bas. 1956, s. 378–383. DOI 10.1002/recl.19560750403.
- ↑ Robert Burns Woodward; Roald Hoffmann. The Conservation of Orbital Symmetry. Angewandte Chemie International Edition. 1969, s. 781–853. DOI 10.1002/anie.196907811.
- ↑ Robert Burns Woodward; Roald Hoffmann. The Conservation of Orbital Symmetry. Weinheim: Verlag Chemie, Academic Press, 1971. Dostupné online. ISBN 978-1483256153.
- ↑ The Photochemical Rearrangement of 4,4-Diphenylcyclohexadienone. Paper I on a General Theory of Photochemical Reactions, Zimmerman, H. E.; Schuster, D. I. Journal of the American Chemical Society, 1961, 83, 4486-4487
- ↑ a b Howard E. Zimmerman; David I. Schuster. A New Approach to Mechanistic Organic Photochemistry. IV. Photochemical Rearrangements of 4,4-Diphenylcyclohexadienone. Journal of the American Chemical Society. 1962, s. 4527–4540. DOI 10.1021/ja00882a032.
- ↑ Mario Schiavello: Photoelectrochemistry, Photocatalysis and Photoreactors Fundamentals and Developments. Springer Netherlands, 2009, ISBN 978-90-481-8414-9, p. 564
- ↑ Martin Fischer: Industrial Applications of Photochemical Syntheses, Angewandte Chemie International Edition in English. 17, 1978, p. 16–26, doi:10.1002/anie.197800161
- ↑ Dieter Wöhrle, Michael W. Tausch, Wolf-Dieter Stohrer: Photochemie: Konzepte, Methoden, Experimente. Wiley & Sons, 1998, ISBN 978-3-527-29545-6, p. 271–275
- ↑ DU PONT. Process of Chlorination. Původci vynálezu: F. Sparre, W. E. Masland. US. Grant 1379367. 1921-05-24. Dostupné: <online>.
- ↑ Process and Apparatus for the Chlorination of Methane. Původci vynálezu: Ziffer Fritz, Richard Leiser. US. Grant 1459777. 1920-02-14. Dostupné: <online>.
- ↑ R. L. Cargill; J. R. Dalton; G. H. Morton; W. E. Photocyclization of an Enone to an Alkene: 6-Methylbicyclo[4.2.0]Octan-2-One. Organic Syntheses. 1984, s. 118. DOI 10.15227/orgsyn.062.0118.
- ↑ Mechanistic and Exploratory Organic Photochemistry, IX. Phenyl Migration in the Irradiation of 4.4-Diphenylcyclohexenone, Zimmerman, H. E.; Wilson, J. W. Journal of the American Chemical Society, 1964, 86, 4036-4042
- ↑ Photochemical Migratory Aptitudes in Cyclohexenones. Mechanistic and Exploratory Organic Photochemistry. XXIII, Zimmerman, H. E.; Rieke, R. D.; Scheffer, J. R. Journal of the American Chemical Society, 1967, 89, 2033-2047
- ↑ Unsymmetrical Substitution and the Direction of the Di-pi-Methane Rearrangement; Mechanistic and Exploratory Organic Photochemistry. LVI, Zimmerman, H. E.; Pratt, A. C. Journal of the American Chemical Society, 1970, 92, 6259-6267
- ↑ The Di-pi-Methane Rearrangement. Interaction of Electronically Excited Vinyl Chromophores. Zimmerman, H. E.; Mariano, P. S. Journal of the American Chemical Society, 1969, 91, 1718-1727
- ↑ Zimmerman, H. E.; Grunewald, G. L. (1966). The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene. Journal of the American Chemical Society 88 (1): 183–184 DOI:10.1021/ja009