Di-π-methanový přesmyk
Di-π-methanový přesmyk je organická fotochemická reakce u sloučeniny obsahující dvě vazby pí oddělené nasyceným atomem uhlík (a 1,4-dienu nebo allylovaného aromatického kruhu), kterou vzniká enovaný- nebo arylovaný derivát cyklopropanu. Při tomto přesmyku se odehraje 1,2-přesun enové (u dienu) nebo arylové (u allylovaných aromatických sloučenin) a vytvoří se vazba mezi postranními uhlíky nepřesouvající se skupiny.[1][2]
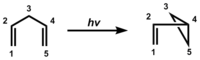
Objev a mechanismus[editovat | editovat zdroj]
Tento druh přesmyku byl poprvé pozorován u fotolýzy barrelenu na semibullvalen.[3]
Howard Zimmerman v roce 1967 zjistil, že k provedení tohoto přesmyku jsou nutné dvě skupiny obsahující vazby pí navázané na sp3-hybridizovaný uhlík, a provedl řadu obdobných reakcí, jako je například fotolýza 1,1,5,5-tetrafenyl-3,3-dimethylpenta-1,4-dienu.[4][5][6] Další případ představuje reakce Prattova dienu.[7]

U Prattova dienu se objevují dvě možné regiochemie - a a b. Mechanismus a převládá tehdy, když zůstává stabilizace benzhydrylu lichým elektronem nedotčena.

Přesmyk barrelenu je poněkud složitější, protože se v jeho molekule vyskytují dva sp3-hybridizované (methanové) uhlíky. Každý takový uhlík má tři (ethylenové) vazby pí, zatímco na přesmyk jsou potřeba dvě. Rozdíl tkví také v tom, že barrelen se přesmykuje v tripletovém excitovaném stavu, zatímco uvedené acyklické dieny využívají excitovaný singlet. U reakce barrelenu se tak jako rozpouštědlo používá aceton, který zachytává světlo a následně excituje tripletový barrelen. V posledním kroku dojde ke spárování elektronů a vytvoření nové vazby sigma.

Tripletové acyklické 1,4-dieny mohou procházet cis-trans izomerizacemi dvojných vazeb, což zamezuje di-π-methanovým přesmykům; cis-trans izomerizace zahrnuje zeslabení vazby pí a následné otočení konfigurace. Singletové excitované stavy nerotují a mohou se tak přeměňovat di-π-methanovým mechanismem. U cyklických dienů, jako je barrelen, cyklická struktura brání cis-trans izomerizacím, což dává prostor k di-π-methanovým přesmykům.
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Di-pi-methane rearrangement na anglické Wikipedii.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.d01745. (anglicky) DOI: 10.1351/goldbook.
- ↑ Howard E. Zimmerman; Diego Armesto. Synthetic Aspects of the Di-π-methane Rearrangement. Chemical Reviews. 1996, s. 3065–3112. DOI 10.1021/cr910109c. PMID 11848853.
- ↑ H. E. Zimmerman; G. J. Grunewald. The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene. Journal of the American Chemical Society. 1966, s. 183–184. DOI 10.1021/ja00953a045.
- ↑ Howard E. Zimmerman; Roger W. Binkley; Richard S. Givens; Maynard A. Sherwin. Mechanistic organic photochemistry. XXIV. The mechanism of the conversion of barrelene to semibullvalene. A general photochemical process. Journal of the American Chemical Society. 1967, s. 3932–3933. ISSN 0002-7863. DOI 10.1021/ja00991a064.
- ↑ H. E. Zimmerman; P. S. Mariano. The Di-π-methane Rearrangement. Interaction of Electronically Excited Vinyl Chromophores. Journal of the American Chemical Society. 1969, s. 1718–1727. ISSN 0002-7863. DOI 10.1021/ja01035a021.
- ↑ Stephen S. Hixson; Patrick S. Mariano; H. E. Zimmerman. The di-π-methane and oxa-di-π-methane rearrangements. Chemical Reviews. 1973, s. 531. DOI 10.1021/cr60285a005.
- ↑ H. E. Zimmerman; A. C. Pratt. Unsymmetrical Substitution and the Direction of the Di-π-Methane Rearrangement; Mechanistic and Exploratory Organic Photochemistry. LVI. Journal of the American Chemical Society. 1970, s. 6259–6267. DOI 10.1021/ja00724a026.
Literatura[editovat | editovat zdroj]
- Mechanistic Organic Photochemistry. XXIV. The Mechanism of the Conversion of Barrelene to Semibullvalene. A General Photochemical Process, Zimmerman, Binkley, R. W.; Givens, R. S.; Sherwin, M. A. Journal of the American Chemical Society, 1967, 89, 3932-3933
- The Di-pi-Methane Rearrangement. Interaction of Electronically Excited Vinyl Chromophores. Zimmerman, H. E.; Mariano, P. S. Journal of the American Chemical Society, 1969, 91, 1718-1727
- The Di-pi-Methane Rearrangement of Naphthobarrelenes. Mechanistic and Exploratory Organic Photochemistry. L. Zimmerman, H. E.; Bender, C. O. Journal of the American Chemical Society, 1970, 92, 4366-4376
- Unsymmetrical Substitution and the Direction of the Di-pi-Methane Rearrangement; Mechanistic and Exploratory Organic Photochemistry. LVI, Zimmerman, H. E.; Pratt, A. C. Journal of the American Chemical Society, 1970, 92, 6259-6267
- Electron Delocalization as a Controlling Factor in the Di-pi-Methane Rearrangement. Exploratory and Mechanistic Organic Photochemistry. LXII, Zimmerman, H. E.; Baum, A. A. Journal of the American Chemical Society, 1971, 93, 3646-3653
- Competitive Photochemical Pathways in the Di-pi-Methane Rearrangement. Exploratory and Mechanistic Organic Photochemistry. LXIII, Zimmerman, H. E.; Hackett, P.; Juers, D. F.; McCall, J. M.; Schröder, B. Journal of the American Chemical Society, 1971, 93, 3653-3662
- The Stereochemistry of the Di-pi-Methane Rearrangement; Mechanistic and Exploratory Organic Photochemistry. LXIX, Zimmerman, H. E.; Baeckstrom, P.; Johnson, T.; Kurtz, D. W. Journal of the American Chemical Society, 1972, 94, 5504-5505
- An Unexpected Sigma Plus Pi Rearrangement of a Di-pi-Methane Reactant. Inhibition of the Di-p-Methane Rearrangement. Mechanistic and Exploratory Organic Photochemistry. LXX, Zimmerman, H. E.; Pincock, J. A. Journal of the American Chemical Society, 1972, 94, 6208-6209
- The Di-p-Methane and Oxa-di-pi-Methane Rearrangements, Hixson, S. S.; Mariano, P. S.; Zimmerman, H. E. Chemical Reviews, 1973, 73, 531-551
- Five Decades of Mechanistic and Exploratory Organic Photochemistry, Zimmerman, H. E., Pure and Applied Chemistry, 2006, 2193-2203
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Di-π-methanový přesmyk na Wikimedia Commons
Obrázky, zvuky či videa k tématu Di-π-methanový přesmyk na Wikimedia Commons
