Komplexy přechodných kovů s karbeny
Komplexy přechodných kovů s karbeny jsou organokovové sloučeniny obsahující dvojvazné organické ligandy patřící mezi karbeny; takovéto komplexy byly popsány u téměř všech přechodných kovů a je znám i velký počet způsobů jejich přípravy i jejich zapojení do reakcí. Označení ligandů jako karbenových je často jen formální, protože řada z nich není odvozena od karbenů a téměř žádný nevykazuje reaktivitu typickou pro karbeny. Často se popisují obecným vzorcem M=CR2, jedná se o přechodné sloučeniny mezi alkyly (-CR3) a karbyny (≡CR). Účastní se některých katalytických reakcí, jako jsou metateze alkenů, a příprav některých sloučenin.
Rozdělení
[editovat | editovat zdroj]Karbenové komplexy kovů se dělí na dvě skupiny. První jsou Fischerovy karbeny, pojmenované po Ernstu Ottu Fischerovi, u nichž jsou kovy silnými π-akceptory a karbenové atomy uhlíku mají elektrofilní vlastnosti. Schrockovy karbeny, které mají název po Richardu Schrockovi, se vyznačují větší nukleofilitou karbenových uhlíků; kovy v nich obvykle mívají vyšší oxidační čísla. V roce 1991 byly poprvé získány volné N-heterocyklické karbeny.[1]
Komplexy karbenů mají široké rozpětí možných substituentů a reaktivit, často je nelze popsat z hlediska elektrofility či nukleofility.
Fischerovy karbeny
[editovat | editovat zdroj]Fischerovy karbeny většinou obsahují:
- kovová centra s nízkými oxidačními čísly[2]
- střední a pozdní přechodné kovy Fe0, Mo0, Cr0
- kovy chovající se jako akceptory π-elektronů z ligandů
- π-donorové substituenty, jako jsou alkoxy a alkylaminové skupiny.
Vazby v těchto karbenech jsou založeny na dodávání σ-elektronů z volných elektronových párů v zaplněných orbitalech karbenových uhlíků do prázdných d-orbitalů kovů a π-elektronů zaplněných d-orbitalů kovů do prázdných p-orbitalů uhlíkových atomů. Příkladem takového komplexu může být (CO)5Cr=C(NR2)Ph.
Fischerovy karbeny se podobají ketonům, protože karbenové uhlíky jsou u nich elektrofilní, podobně jako karbonylové uhlíky u ketonů. Stejně jako ketony mohou také Fischerovy karbeny vstupovat do reakcí podobajících se aldolovým. Atomy vodíku navázané na uhlík v poloze α vůči karbenovému uhlíku jsou kyselé a lze je odštěpit pomocí zásad, například n-butyllithia, čímž se vytváří nukleofily, které se mohou účastnit dalších reakcí.[3]
Karbeny tohoto druhu jsou výchozími látkami například Wulffových–Dötzových reakcí.
Schrockovy karbeny
[editovat | editovat zdroj]Schrockovy karbeny nemají π-akceptorové ligandy a jejich karbenové atomy uhlíku jsou nukleofilní. Obvykle se vyznačují:
- vysokými oxidačními čísly kovových center
- přítomností raných přechodných kovů (například Ti4+, Ta5+)
- π-donorovými ligandy
- vodíkovými a alkylovými substituenty na karbenoidových uhlících.
Vazby v těchto komplexech se popisují jako spojení tripletových kovů a tripletových karbenů. Jsou polarizované vůči karbenům, což dodává karbenovým uhlíkům vlastnosti nukleofilů. Příkladem je sloučenina Ta(=C(H)But)(CH2Bu t
3 )3, jejíž tantaličné centrum je spojeno dvojnými vazbami s neopentylidenovým a třemi neopentylovými ligandy. V organické syntéze má využití Tebbeovo činidlo.
N-heterocyklické karbeny
[editovat | editovat zdroj]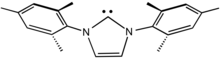
IMes je jedním z běžných 'N-heterocyklických karbenových ligandů.
N-heterocyklické karbeny jsou poměrně časté;[4] připravují se snadněji než Schrockovy a Fischerovy karbeny. Řadu z nich lze izolovat jako volné ligandy. V důsledku silné stabilizace π-donorovými substituenty jsou dobrými σ-donory, ale jejich vazby π na kovy jsou slabé.[5] Z těchto důvodů jsou u nich vazby mezi uhlíkem a kovem často popisovány jako jednoduché, zatímco u Fischerových a Schrockových karbenů jako dvojné. N-heterocyklické karbeny se často porovnávají s trialkylfosfiny. Podobně jako ony ovlivňují katalýzu kombinací elektronových a sterických efektů, ovšem na substráty se nenavazují přímo.[6][7]
V laboratořích byly připraveny i karbeny bez navázaných ligandů.[8][9]
Karbenové radikály
[editovat | editovat zdroj]Karbenové radikály[10] jsou dlouhotrvajícími meziprodukty a vyznačují se:[11][12][13]
- kovovými centry v nízkých oxidačních číslech, s d 2
z orbitaly obsazenými jedním elektronem - středními a pozdními přechodnými kovy, jakými jsou Co2+[14]
- jedná se o σ-donory a π-akceptory, jejichž ligandy obsahují π-akceptorové substituenty, jako například karbonylové nebo sulfonylové skupiny. Vazby v nich odpovídají svými vlastnostmi částečně Fischerovým a částečně Schrockovým karbenům.

Použití
[editovat | editovat zdroj]Hlavní využití karbenových komplexů kovů je v heterogenní katalýze metatezí alkenů, zahrnujících řadu podobných reakcí, kterými se navzájem přeměňují lehké alkeny, jako jsou buteny, propen a ethen. Karbenové komplexy jsou meziprodukty Fischerovy–Tropschovy syntézy. V laboratorních syntézách přírodních látek a v materiálových vědách se používá několik karbenových katalyzátorů, například Grubbsovy a molybden-imidové katalyzátory, ovšem významnější průmyslové využití nemají. Odštěpení methylových skupin z Fischerových karbenů může být využito k dalším reakcím, jako jsou nukleofilní substituce.
Diazosloučeniny, například methylfenyldiazoacetát, mohou cyklopropanovat organické substráty nebo se navazovat na jejich vazby C-H; tyto reakce bývají katalyzovány octanem rhodnatým nebo jeho chirálními deriváty a katalytické cykly probíhají pravděpodobně přes karbenové komplexy.[15][16]
Historie
[editovat | editovat zdroj]
První známý karbenový komplex, Čugajevova červená sůl, byl identifikován až desítky let po první přípravě.[4]
Za počátek výzkumu karbenových komplexů se považuje příprava (CO)5W(COCH3Ph) v 60. letech 20. století,[17] přestože byly přípravy karbenoidových ligandů oznámeny již dříve. Ernst Otto Fischer za tyto a další objevy v organokovové chemii v roce 1973 získal Nobelovu cenu za chemii.[17]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Transition metal carbene complex na anglické Wikipedii.
- ↑ A. J. Arduengo; R. L. Harlow; M. Kline. A stable crystalline carbene. Journal of the American Chemical Society. 1991, s. 361–363. DOI 10.1021/ja00001a054.
- ↑ HEGEDUS, Lous S.; MCGUIRE, Michael A.; SCHULTZE, Lisa M. 1,3-Dimethyl-3-methoxy-4-phenylazetidinone. Org. Synth.. S. 140. DOI 10.15227/orgsyn.065.0140.
- ↑ Robert H. Crabtree. The Organometallic Chemistry of the Transition Metals. [s.l.]: Wiley-Interscience, 2005. Dostupné online. ISBN 978-0-471-66256-3.
- ↑ a b F. E. Hahn; M. C. Jahnke. Heterocyclic carbenes: synthesis and coordination chemistry. Angewandte Chemie. 2008. DOI 10.1002/anie.200703883. PMID 18398856.
- ↑ K. L. Fillman; J. A. Fillman; M. H. Al-Afyouni; M. L. Neidig. N-heterocyclic carbene complexes. Chemical Science. 2015, s. 1178–1188. DOI 10.1039/c4sc02791d. PMID 25621143.
- ↑ Jacob A. Przyojski; Kevin P. Veggeberg; Hadi D. Arman; Zachary J. Tonzetich. Mechanistic Studies of Catalytic Carbon–Carbon Cross-Coupling by Well-Defined Iron NHC Complexes. ACS Catalysis. 2015-09-08, s. 5938–5946. DOI 10.1021/acscatal.5b01445.
- ↑ Jacob A. Przyojski; Hadi D. Arman; Zachary J. Tonzetich. NHC Complexes of Cobalt(II) Relevant to Catalytic C–C Coupling Reactions. Organometallics. 2012-12-18, s. 723–732. DOI 10.1021/om3010756.
- ↑ E. Aldeco-Perez; A. J. Rosenthal; B. Donnadieu; P. Parameswaran; G. Frenking; G. Bertrand. Isolation of a C5-deprotonated imidazolium, a crystalline "abnormal" N-heterocyclic carbene. Science. 2009, s. 556–559. DOI 10.1126/science.1178206. Bibcode 2009Sci...326..556A.
- ↑ Anthony J. Arduengo; Jens R. Goerlich; William J. Marshall. A stable diaminocarbene. Journal of the American Chemical Society. 2002-05-01, s. 11027–11028. DOI 10.1021/ja00149a034.
- ↑ W. I. Dzik; X. P. Zhang; B. de Bruin. Redox noninnocence of carbene ligands: carbene radicals in (catalytic) C-C bond formation. Inorganic Chemistry. 2011, s. 9896–9903. DOI 10.1021/ic200043a. PMID 21520926.
- ↑ W. I. Dzik; X. Xu; X. P. Zhang; J. N. Reek; B. de Bruin. 'Carbene radicals' in Co(II)(por)-catalyzed olefin cyclopropanation. Journal of the American Chemical Society. 2010, s. 10891–10902. DOI 10.1021/ja103768r. PMID 20681723.
- ↑ Bergin Enda. Asymmetric catalysis. Annual Reports on the Progress of Chemistry, Section B: Organic Chemistry. 2012, s. 353–371. DOI 10.1039/c2oc90003c.
- ↑ Robert A. Moss; Michael P. Doyle. Contemporary Carbene Chemistry. [s.l.]: John Wiley and Sons, 2013. ISBN 978-1118730263.
- ↑ A. Chirila; B. Gopal Das; N. D. Paul; B. de Bruin. Diastereoselective Radical-Type Cyclopropanation of Electron-Deficient Alkenes Mediated by the Highly Active Cobalt(II) Tetramethyltetraaza[14]annulene Catalyst. ChemCatChem. 2017, s. 1413–1421. DOI 10.1002/cctc.201601568. PMID 28529668.
- ↑ H. M. L. Davies; D. Morton. Guiding Principles for Site Selective and Stereoselective Intermolecular C–H Functionalization by Donor/Acceptor Rhodium Carbenes. Chemical Society Reviews. 2011, s. 1857–1869. DOI 10.1039/C0CS00217H. PMID 21359404.
- ↑ Ramajeyam Selvaraj; Srinivasa R. Chintala; Michael T. Taylor; Joseph M. Fox. 3-Hydroxymethyl-3-phenylcyclopropene. Organic Syntheses. 2014, s. 322. DOI 10.15227/orgsyn.091.0322.
- ↑ a b E. O. Fischer; A. Maasböl. On the Existence of a Tungsten Carbonyl Carbene Complex. Angewandte Chemie International Edition in English. 1964, s. 580–581. DOI 10.1002/anie.196405801.


