Trimerizace alkynů
Trimerizace alkynů je [2+2+2] cykloadiční reakce, při níž ze tří ekvivalentů alkynu vzniká jeden ekvivalent sloučeniny s benzenovým jádrem, za katalýzy kovem. Využití mají tyto reakce v organické syntéze.[1]
Je známa řada takových reakcí, přičemž lze při nich využít také směsí alkynů s alkeny nebo s nitrily.
Mechanismus a stereochemie
[editovat | editovat zdroj]Trimerizace acetylenu na benzen je silně exergonní, změna energie za pokojové teploty činí téměř 600 kJ/mol; snadnému průběhu ale brání kinetické překážky.
V roce 1948 oznámili Walter Reppe a W. J. Schweckendiek, že trimerizace alkynů mohou být účinně katalyzovány sloučeninami niklu:[2][3]
Později bylo popsáno mnoho dalších cyklotrimerizací.[4]
Mechanismus
[editovat | editovat zdroj]Reakce začíná tvorbou komplexu alkynu a kovu. Navázáním dvou molekul alkynu do koordinační sféry vznikne metalacyklopentadien.[5] Následně může vznikat řada různých meziproduktů, například metalacykloheptatrieny, metalanorbornadieny, a také složitější struktury obsahující karbenoidové ligandy.[4]
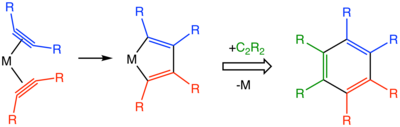
Stereochemie a regiochemie
[editovat | editovat zdroj]Trimerizacemi nesymetrických alkynů se vytváří dvojice navzájem izomerních produktů, například z fenylacetylenu vzniká 1,3,5- i 1,2,4-C6R3H3. Stereochemii produktu ovlivňují dva faktory: tvorba metalocyklopentadienového meziproduktu a třetí ekvivalent alkynu. Regioselektiuvitu určují sterické efekty reaktantů a katalyzátoru.

Chirální katalyzátory mpohou ve spojení s aryny vést k neracemickým atropizomerům.[6]
Rozsah a omezení
[editovat | editovat zdroj]Katalyzátory cyklotrimerizací jsou selektivní vůči trojným vazbám, což umožňuje použití širokého rozsahu substrátů. Mezimolekulární trimerizace nesymetrických alkynů nebyly dosud provedeny.[4]
Průmyslově nejvýznamnějšími cyklotrimerizacemi jsou reakce alkynů s nitrily, kterými se vyrábí některé substituované pyridiny.[7]
Některé katalyzátory jsou deaktivovávány tvorbou stabilních 18elektronových η4-komplexů. U deaktivovaných katalyzátorů byly pozorovány komplexy cyklobutadienu, cyklohexadienů a arenů.[8]
Kromě polymerů, dimerů a trimerů, vznikajících s nízkými regio- a chemoselektivitami, byly pozorovány také enynové vedlejší produkty vznikající dimerizacemi alkynů. K vytváření enynů bývají obzvlášť náchylné reakce katalyzované rhodiem.[9]
U niklových katalyzátorů se často vytváří větší kruhy (především cyklooktatetraeny).
Využití
[editovat | editovat zdroj]Samotné trimerizace alkynů nemají praktické využití, ale ovlivnily řadu dalších procesů. Kotrimerizatce alkynů s nitrily za přítomnosti organických komplexů kobaltu se používaj na výrobu substituovaných pyridinů.[10]
Cyklizacemi využívjícími substráty, které mají všechny nebo některé alkynové skupiny „připoutané“ k sobě, lze získávat molekuly obsahující polycykly. Přidání 1,5-diynu k alkynu vyvolá tvorbu benzocyklobutenu, který lze zapojit do dalších reakcí.[11]
Při připoutání všech tří alkynových jednotek je možné v jednom kroku vytvořit tři kruhy.[12]
Cyklizacemi triynů mohou vznikat sloučeniny vykazující helikální chiralitu; příkladem může být reakce, kdy se v jednom kroku vytváří tři aromatické kruhy reakcí triynu za přítomnosti dikarbonylu cyklopentadienylkobaltu.[13]
Pomocí komerčně dostupného dikarbonylu cyklopentadienylkobaltu, CpCo(CO)2, jako katalyzátoru lze provést reakci bis(trimethylsilyl)acetylenu s 1,2-diynovaným benzenem za vzniku antrachinonu:[14]
Benzyn, vytvořený in situ z benzenu s navázanou triflátovou a trimethylsilylovou skupinou, které jsou vzájemně v poloze ortho, lze použít místo acetylenu a zreagovat jej s vhodným diynem. S okta-1,7-diynem se vznikne naftalenový systém (1,2,3,4-tetrahydroanthracen),[15] přičemž jde o příklad hexadehydro Dielsovy–Alderovy reakce.
Trimerizací but-2-ynu vzniká hexamethylbenzen;[16] reakci může katalyzovat tri-tetrahydrofuranát trifenylchromu[17] nebo komplex triisobutylhliníku s chloridem titaničitým.[18]

Srovnání s ostatními postupy
[editovat | editovat zdroj]Cyklotrimerizace jsou alternativami funkcionalizací předem vytvořených aromatických sloučenin prostřednictvím elektrofilních nebo nukleofilních substitucí, jejichž regioselektivitu může být obtížné ovládat.
Dalšími způsoby přímé tvorby aromatických sloučenin ze substituovaných nenasycených prekurzorů jsou Dötzova reakce, palladiem katalyzovaná [4+2] benzanelace enynů alkyny,[19] a [4+2] cykloadiční reakce enynů s alkyny řízené Lewisovými kyselinami[20] a cyklizace benzynů alkyny, katalyzované palladiem.[21]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Alkyne trimerisation na anglické Wikipedii.
- ↑ N. Agenet; O. Buisine; F. Slowinski; V. Gandon; C. Aubert; M. Malacria. Cotrimerizations of Acetylenic Compounds. Organic Reactions. 2007. ISBN 978-0471264187. DOI 10.1002/0471264180.or068.01.
- ↑ W. Reppe; W. J.. Schweckendiek. Cyclisierende Polymerisation von Acetylen. III Benzol, Benzolderivate und hydroaromatische Verbindungen. Liebigs Annalen. 1948, s. 104–116. DOI 10.1002/jlac.19485600104.
- ↑ W. Reppe; H. Vetter. Carbonylierung VI. Synthesen mit Metallcarbonylwasserstoffen. Liebigs Annalen. 1953, s. 133–161. DOI 10.1002/jlac.19535820107.
- ↑ a b c d Daniel L. J. Broere; Eelco Ruijter. Recent advances in transition-metal-catalyzed [2 + 2 + 2]-cyclo(co)trimerization reactions. Synthesis. 2012, s. 2639–2672. DOI 10.1055/s-0032-1316757.
- ↑ Wangyang Ma; Chao Yu; Tianyang Chen; Ling Xu; Wen-Xiong Zhang; Zhenfeng Xi. Metallacyclopentadienes: synthesis, structure and reactivity. Chemical Society Reviews. 2017, s. 1160–1192. ISSN 0306-0012. DOI 10.1039/C6CS00525J. PMID 28119972.
- ↑ Takanori Shibata; Kyoji Tsuchikama. Recent advances in enantioselective [2 + 2 + 2] cycloaddition. Organic & Biomolecular Chemistry. 2008, s. 1317–1323. ISSN 1477-0520. DOI 10.1039/b720031e. PMID 18385836.
- ↑ Jesus Varela; Carlos Saa. Construction of Pyridine Rings by Metal-Mediated [2 + 2 + 2] Cycloaddition. Chemical Reviews. 2003-03-20, s. 3787–3802. DOI 10.1021/cr030677f. PMID 12964884.
- ↑ U. Kölle; B. Fuss. Pentamethylcyclopentadienyl-Übergangsmetall-Komplexe, X. Neue Co-Komplexe aus η5-C5Me5Co-Fragmenten und Acetylenen. Chemische Berichte. 1986, s. 116–128. DOI 10.1002/cber.19861190112.
- ↑ G. A. Ardizzoia; S. Brenna; S. Cenini; G. LaMonica; N. Masciocchi; A. Maspero. Oligomerization and Polymerization of Alkynes Catalyzed by Rhodium(I) Pyrazolate Complexes. Journal of Molecular Catalysis A: Chemical. 2003, s. 333–340. DOI 10.1016/S1381-1169(03)00315-7.
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a22_399. (anglicky) DOI: 10.1002/14356007.
- ↑ K. Peter C. Vollhardt. Cobalt-assisted [2+2+2] cycloadditions: a synthesis strategy grows to maturity. Angewandte Chemie. 1984, s. 525–541. DOI 10.1016/S1381-1169(03)00315-7.
- ↑ S. J. Neeson; P. J. Stevenson. Rhodium catalysed [2+2+2] cycloadditions- an efficient regiospecific route to calomelanolactone. Tetrahedron Letters. 1988, s. 813. DOI 10.1016/S0040-4039(00)80217-8.
- ↑ F. Teply; I. G. Stara; I. Stary; A. Kollarovic; D. Saman; L. Rulisek; P. Fiedler. Synthesis of 5-, 6-, and 7helicene via Ni(0)- or Co(I)-catalyzed isomerization of aromatic cis,cis-dienetriynes. Journal of the American Chemical Society. 2002, s. 9175–9180. DOI 10.1021/ja0259584. PMID 12149022.
- ↑ R. L. Hillard; K. P. C. Vollhardt. Substituted Benzocyclobutenes, Indans, and Tetralins via Cobalt-Catalyzed Cooligomerization of α,ω-diynes with Substituted Acetylenes. Formation and Synthetic Utility of Trimethylsilylated Benzocycloalkenes. Journal of the American Chemical Society. 1977, s. 4058–4069. DOI 10.1021/ja00454a026.
- ↑ J.-C. Hsieh; C.-H. Cheng. Nickel-Catalyzed Cocyclotrimerization of Arynes with Diynes; A Novel Method for Synthesis of Naphthalene Derivatives. Chemical Communications. 2005, s. 2459–2461. DOI 10.1039/b415691a. PMID 15886770.
- ↑ S. R. Weber; H. H. Brintzinger. Reactions of Bis(hexamethylbenzene)iron(0) with Carbon Monoxide and with Unsaturated Hydrocarbons. Journal of Organometallic Chemistry. 1977, s. 45–54. Dostupné online. DOI 10.1016/S0022-328X(00)84196-0.
- ↑ H. H. Zeiss; W. Herwig. Acetylenic π-complexes of chromium in organic synthesis. Journal of the American Chemical Society. 1958, s. 2913. DOI 10.1021/ja01544a091.
- ↑ B. Franzus; P. J. Canterino; R. A. Wickliffe. Titanium tetrachloride–trialkylaluminum complex—A cyclizing catalyst for acetylenic compounds. Journal of the American Chemical Society. 1959, s. 1514. DOI 10.1021/ja01515a061.
- ↑ V. Gevorgyan; A. Takeda; H. Homma; N. Sadayori; U. Radhakrishnan; Y. Yamamoto. Palladium-Catalyzed [4+2]Cross-Benzannulation Reaction of Conjugated Enynes with Diynes and Triynes. Journal of the American Chemical Society. 1999, s. 6391. DOI 10.1021/ja990749d.
- ↑ M. S. B. Wills; Rick L. Danheiser. Intramolecular [4 + 2] Cycloaddition Reactions of Conjugated Ynones. Formation of Polycyclic Furans via the Generation and Rearrangement of Strained Heterocyclic Allenes. Journal of the American Chemical Society. 1998, s. 9378. DOI 10.1021/ja9819209.
- ↑ Y. Sato; T. Tamura; M. Mori. Arylnaphthalene lignans through Pd-Catalyzed 2+2+2 cocyclization of arynes and diynes: total synthesis of Taiwanins C and E. Angewandte Chemie International Edition in English. 2004, s. 2436–2440. DOI 10.1002/anie.200453809. PMID 15114584.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Trimerizace alkynů na Wikimedia Commons
Obrázky, zvuky či videa k tématu Trimerizace alkynů na Wikimedia Commons
Literatura
[editovat | editovat zdroj]- MUSSO, F.; SOLARI, E.; FLORIANI, C. Hydrocarbon Activation with Metal Halides: Zirconium Tetrachloride Catalyzing the Jacobsen Reaction and Assisting the Trimerization of Alkynes via the Formation of η6-Arene−Zirconium(IV) Complexes. Organometallics. 1997, s. 4889. DOI 10.1021/om970438g.
- RODRÍGUEZ, J. Gonzalo; MARTÍN-VILLAMIL, Rosa; FONSECA, Isabel. Tris(2,4-pentanedionato)vanadium-catalysed cyclotrimerization and polymerization of 4-(N,N-dimethylamino)phenylethyne: X-ray structure of 1,2,4-tris[4-(N,N -dimethylamino)phenyl]benzene. Journal of the Chemical Society, Perkin Transactions 1. 1997, s. 945–948. ISSN 0300-922X. DOI 10.1039/a605474i.
- Sakurai, H.; NAKADAIRA, Y.; HOSOMI, A.; ERIYAMA, Y.; HIRAMA, K.; KABUTO, C. Chemistry of organosilicon compounds. 193. Intramolecular cyclotrimerization of macrocylic and acyclic triynes with Group 6 metal carbonyls. The formation of fulvene and benzene. Journal of the American Chemical Society. 1984, s. 8315. DOI 10.1021/ja00338a063.
- Amer, I.; BERNSTEIN, T.; EISEN, M.; BLUM, J.; VOLLHARDT, K. P. C. Oligomerization of alkynes by the RhCl3-aliquat 336 catalyst system Part 1. Formation of benzene derivatives. Journal of Molecular Catalysis. 1990, s. 313. DOI 10.1016/0304-5102(90)85254-F.
- Lee, C. L.; HUNT, C. T.; BALCH, A. L. Novel reactions of metal-metal bonds. Reactions of Pd2{(C6H5)2PCH2P(C6H5)2}2Cl2 with acetylenes, olefins, and isothiocyanates. Inorganic Chemistry. 1981, s. 2498. DOI 10.1021/ic50222a026.
- Aalten, H. L.; VAN KOTEN, G.; RIETHORST, E.; STAM, C. H. The Hurtley reaction. 2. Novel complexes of disubstituted acetylenes with copper(I) benzoates having a reactive ortho carbon-chlorine or carbon-bromine bond. X-ray structural characterization of tetrakis(2-chlorobenzoato)bis(diethyl acetylenedicarboxylate)tetracopper(I). Inorganic Chemistry. 1989, s. 4140. DOI 10.1021/ic00321a020.
- Hardesty, J. H.; KOERNER, J. B.; ALBRIGHT, T. A.; LEE, G. B. Theoretical Study of the Acetylene Trimerization with CpCo. Journal of the American Chemical Society. 1999, s. 6055. DOI 10.1021/ja983098e.
- Ozerov, O. V.; PATRICK, B. O.; LADIPO, F. T. Highly Regioselective [2 + 2 + 2] Cycloaddition of Terminal Alkynes Catalyzed by η6-Arene Complexes of Titanium Supported by Dimethylsilyl-Bridgedp-tert-Butyl Calix[4]arene Ligand. Journal of the American Chemical Society. 2000, s. 6423. DOI 10.1021/ja994543o.







