Methan: Porovnání verzí
m /+věta a odkaz |
→Ekologické účinky: chybí zdroj |
||
| Řádek 88: | Řádek 88: | ||
==Ekologické účinky== |
==Ekologické účinky== |
||
Vzhledem k tomu, že silně absorbuje [[infračervené záření]], patří mezi významné [[skleníkový plyn|skleníkové plyny]] (cca 20× účinnější než [[oxid uhličitý]]), zvyšující teplotu zemské atmosféry. |
Vzhledem k tomu, že silně absorbuje [[infračervené záření]], patří mezi významné [[skleníkový plyn|skleníkové plyny]] (cca 20× účinnější než [[oxid uhličitý]]{{doplňte zdroj}}), zvyšující teplotu zemské atmosféry. |
||
== Související články == |
== Související články == |
||
Verze z 30. 9. 2008, 22:44
Šablona:Infobox Chemická sloučenina Methan (mimo chemii dle PČP metan) neboli podle systematického názvosloví karban je nejjednodušší alkan a tedy i nejjednodušší uhlovodík vůbec. Při pokojové teplotě je to netoxický plyn bez barvy a zápachu, lehčí než vzduch (relativní hustota 0,55 při 20 °C).
Příprava
Hlavním zdrojem methanu je přírodní surovina, zemní plyn. Přímá příprava sloučením uhlíku s vodíkem je prakticky nemožná, vzhledem k tomu, že by uhlík musel být nejprve převeden do plynného stavu. Teoreticky však lze methan připravit dvoustupňovou syntézou přes sirouhlík
- C + 2 S → CS2,
který pak reakcí se sulfanem (sirovodíkem) a mědí dá methan
- CS2 + 2 H2S + 8 Cu → CH4 + 4 Cu2S.
Jinou možností je reakce karbidu hliníku s vodou
- Al4C3 + 12 H2O → 3 CH4 + 4 Al(OH)3.
Laboratorně se dá připravit žíháním směsi octanu sodného s hydroxidem sodným (natronovým vápnem)
- CH3COONa + NaOH → CH4 + Na2CO3.
Vlastnosti

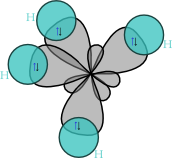
Molekula methanu má symetrii pravidelného čtyřstěnu (bodová grupa symetrie Td), v jehož těžišti se nachází uhlíkový atom a v jehož vrcholech se nacházejí vodíkové atomy. Díky této vysoké symetrii je celkově molekula methanu nepolární, přestože vazby H–C slabou polaritu vykazují.
Methan může reagovat explozivně s kyslíkem
- CH4 + 2 O2 → CO2 + 2 H2O.
Bod samozážehu je sice velmi vysoký (595 ºC, teplota vznícení při koncentraci 8,5 % je 537 ºC), ale stačí např. elektrická jiskra nebo otevřený plamen a směs methanu se vzduchem může být přivedena k výbuchu (minimální iniciační energie je 0,28 mJ). Přitom meze výbušnosti jsou značně velké, od 4,4 do 15 objemových procent. Proto je nezbytně nutné průběžně sledovat koncentraci methanu (důlního plynu) v uhelných dolech, aby se předešlo katastrofám. Podobně prudce může methan reagovat i s plynným chlórem, je-li reakce iniciována prudkým zahřátím. Za normální teploty probíhá pomalu čtyřstupňově za vzniku chlorovaných derivátů methanu
- CH4 + Cl2 → CH3Cl + HCl,
- CH3Cl + Cl2 → CH2Cl2 + HCl,
- CH2Cl2 + Cl2 → CHCl3 + HCl,
- CHCl3 + Cl2 → CCl4 + HCl.
Podobně reaguje i s jinými halogeny. Jinak je málo reaktivní.
Výskyt v přírodě
Methan se přirozeně vyskytuje na Zemi:
- v atmosféře, kam se dostává zejména jako produkt rozkladu látek biogenního původu (bioplyn)
- v podzemí:
- jako hlavní složka zemního plynu
- jako součást důlního plynu v dolech
- rozpuštěný v ropě
- rozpuštěný ve vodě některých jezer, zvláště v Africe (např. jezero Kivu mezi Rwandou a Kongem).
Ve vesmíru byl nalezen v plynných mračnech v mezihvězdném prostoru. Dále pak je součástí atmosfer velkých planet (Jupiter, Saturn, Uran a Neptun). V pevném stavu je součástí tzv. ledových měsíců velkých planet a tvoří zřejmě nezanedbatelnou část hmoty transneptunických těles, případně je vysrážen ve formě ledu nebo jinovatky na jejich povrchu (např. Pluto). Byl také prokázán v komách komet.
Použití
Hlavní oblastí použití methanu je energetika, kde slouží ve směsi s jinými uhlovodíky jako plynné palivo.
Experimentálně byl kapalný methan použit ve směsi s kapalným kyslíkem jako pohonná látka v raketových motorech.
V chemickém průmyslu se používá především k výrobě oxidu uhličitého spalováním se vzduchem a při neúplném spalování k výrobě sazí, používaných jako plnidlo a barvivo v gumárenském průmyslu.
Ekologické účinky
Vzhledem k tomu, že silně absorbuje infračervené záření, patří mezi významné skleníkové plyny (cca 20× účinnější než oxid uhličitý[zdroj?]), zvyšující teplotu zemské atmosféry.
Související články
- Bioplyn
- Anaerobní digesce - proces produkce bioplynu
Externí odkazy
- Methane, CH4, Physical properties, safety
- Umweltlexikon
- Metanová časovaná bomba (o ekologických účincích metanu)
