Karbeniový ion

Karbeniové ionty jsou karbokationty s obecným vzorcem RR′R″C+, obsahují trojvazný uhlík s nábojem +1; tím se liší od karboniových iontů, ve kterých je uhlík naprotonován a je pětivazný.[1] Definici obou těchto pojmů navrhl George Andrew Olah roku 1972.[2]
Karbeniové ionty jsou velmi reaktivní, protože nemají plný elektronový oktet, některé, jako je tropyliový ion, jsou poměrně stabilní díky delokalizaci kladného náboje.
Názvosloví
[editovat | editovat zdroj]Karbeniové ionty se podle počtu uhlíkových atomů navázaných na nabitý uhlík dělí na primární (s jedním navázaným uhlíkem), sekundární (se dvěma) a terciární (se třemi navázanými uhlíky).
Reaktivita
[editovat | editovat zdroj]Stabilita karbeniových iontů obecně roste s počtem alkylových skupin navázaných na nabitý uhlík. Terciární ionty jsou stabilnější (a tedy reagují pomaleji) než sekundární, které jsou zase stabilnější než primární; tento pokles je způsoben postupně slábnoucím vlivem hyperkonjugace. Primární karbeniové ionty jsou značně nestabilní, a pokud se vytvoří, tak reakce jako SN1 reakce a E1 eliminace obvykle neprobíhají.
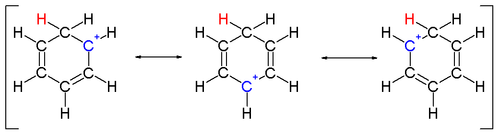
Pokud je však mezi ionizovaným a neutrálním uhlíkem dvojná vazba, tak dochází ke stabilizaci rezonančními strukturami. Některé kationty, například allylový (CH2=CH–CH +
2 ) nebo benzylový kation (C6H5–CH +
2 ) jsou stabilnější než většina ostatních karbokationtů a molekuly, ze kterých mohou vzniknout, jsou obzvlášť reaktivní. Karbeniové ionty mohou být také stabilizovány heteroatomy.[3]
U karbeniových iontů někdy probíhají přesmykové reakce, při níž se málo stabilní struktury mění na stejně stabilní nebo stabilnější, a to více než 109krát za sekundu, což ztěžuje hledání způsobů přípravy mnoha sloučenin. Jako příklad lze uvést zahřívání pentan-3-olu s kyselinou chlorovodíkovou, kdy se původně vytvořený pent-3-ylový karbokation přeměňuje na směs pent-3-ylu a pent-2-ylu. Tyto kationty reagují s chloridovými anionty za vzniku směsi 3-chlorpentanu a 2-chlorpentanu v přibližném poměru 1:3.
Druhy karbeniových iontů
[editovat | editovat zdroj]Alkyliové ionty
[editovat | editovat zdroj]Karbeniové ionty lze připravit přímo z alkanů odstraněním hydridového aniontu (H−) pomocí silné kyseliny. Směs fluoridu antimoničného (SbF5) a kyseliny fluorsírové (FSO3H) přeměňuje isobutan na kation (CH3)3C+.[4]
Aromatické karbeniové ionty
[editovat | editovat zdroj]
Tropyliový kation je aromatická látka se vzorcem C7H +
7 . Jeho název je odvozen od tropinu. Soli tohoto iontu, jako například tetrafluoroboritan tropylia, jsou často stabilní. Lze jej připravit z cykloheptatrienu (nazývaného také tropyliden) a bromu chloridu fosforečného.[5] Je to ion s rovinnou sedmiúhelníkovou molekulou, má také 6 (tedy 4 n + 2) π elektronů, čímž splňuje Hückelovo pravidlo aromaticity. Může jakožto ligand vytvářet komplexní sloučeniny s atomy kovů.
Znázorněný vzorec odpovídá kombinaci sedmi rezonančních struktur, z nichž každá přenáší část kladného náboje.
V roce 1891 byla připravena ve vodě rozpustná sůl reakcí cykloheptatrienu a bromu.[6] Její struktura byla zjištěna roku 1954.[7][8]
Dalším stabilním karbokationtem je cyklopropeniový ion (C3H +
3 ), který byl připraven roku 1970.[9] I když je méně stabilní než tropyliový kation, tak též vytváří soli za pokojové teploty. Roztoky některých z těchto solí mají spektroskopické a chemické vlastnosti, které se očekávají od aromatických karbeniových iontů.
Trifenylmethylový (tritylový) kation
[editovat | editovat zdroj]Trifenylmethylový kation ([C(C6H5)3]+), nazývaný také trimethylkarbenium, je velmi stabilní, protože je u něj kladný náboj rozdělen mezi 10 atomů uhlíku (po třech v polohách ortho a para každé fenylové skupiny a jeden na centrálním atomu). Ke známým sloučeninám tohoto iontu patří hexafluorfosforečnan ([C(C6H5)3]|+[PF6]−), tetrafluorboritan ([C(C6H5)3]|+[BF4]− a chloristan ([C(C6H5)3]|+[ClO4]−.[10] Mezi jeho deriváty patří například triarylmethanová barviva.
Areniové ioty
[editovat | editovat zdroj]
Areniové ionty jsou cyklohexadienylové kationty nebo jejich deriváty, které jsou reaktivními meziprodukty při elektrofilních aromatických substitucích.[11] Také= se nazývají Whelandovy meziprodukty[12] nebo σ komplexy.
Dva vodíkové atomy navázané na uhlík se nacházejí v rovině kolmé na rovinu benzenového jádra.[13] Areniový ion není aromatická látka, díky delokalizaci je ovšem poměrně stabilní; kladný náboj je delokalizován přes pět atomů vytvářejících π systém:
Stabilita areniových iontů je také ovlivňována silnými vazbami mezi benzenem a komplexním elektrofilem.
Nejjednodušším areniovým ionten je protonovaný benzen (C6H +
7 ). Benzeniový ion lze izolovat, pokud je benzen protonován karboranovou superkyselinou, H(CB11H(CH3)5Br6).[14] Vzniklá krystalická benzeniová sůl je stabilní při teplotách do 150 °C. Délky vazeb zjištěné pomocí rentgenové krystalografie odpovídá struktuře cyklohexadienylového kationtu.
Acyliové ionty
[editovat | editovat zdroj]Acyliové ionty jsou ionty s obecným vzorcem RCO+.[15] Jejich struktura se popisuje pomocí vzorců R−C≡O+ nebo R−C+-O. Jedná se o obdobu acylových kationtů, ovšem jejich struktura je jiná; kyslík a uhlík jsou spojeny trojnou vazbou. Některé se běžně objevují jako meziprodukty reakcí, kterými jsou například Friedelovy–Craftsovy reakce nebo Hajašiho přesmyk. Soli těchto iontů lze připravit odstraněním halogenidové skupiny z acylhalogenidů:
- RCOCl + SbCl5 → RCO+SbCl -
6
Vazba C–O má u těchto iontů délku kolem 110 pm, je tedy kratší než v molekule oxidu uhelnatého.[16] Acyliové kationty jsou typickými fragmenty pozorovatelnými v EI hmotnostních spektrech ketonů.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Carbenium ion na anglické Wikipedii.
- ↑ IUPAC Gold Book carbonium ion
- ↑ "Stable carbocations. CXVIII. General concept and structure of carbocations based on differentiation of trivalent (classical) carbenium ions from three-center bound penta- of tetracoordinated (nonclassical) carbonium ions. Role of carbocations in electrophilic reactions" George Andrew Olah; J. Am. Chem. Soc.; 1972; 94(3); 808–820
- ↑ Hansjörg Grützmacher, Christina M. Marchand (1997), "Heteroatom stabilized carbenium ions", Coord. Chem. Rev., 163, 287–344. DOI:10.1016/S0010-8545(97)00043-X
- ↑ George A. Olah and Joachim Lukas (1967), "Stable Carbonium Ions. XLVII. Alkylcarbonium ion formation from alkanes via hydride (alkide) ion abstraction in fluorosulfonic acid-antimony pentafluoride-sulfuryl chlorofluoride solution". J. Am. Chem. Soc. 89 (18), 4739–4744 DOI:10.1021/ja00994a030
- ↑ "Tropylium tetrafluorate" Organic Syntheses, Coll. Vol. 5, p.1138 (1973); Vol. 43, p.101 (1963). link Archivováno 29. 8. 2012 na Wayback Machine.
- ↑ Merling, G. (1891), "Ueber Tropin". Berichte der deutschen chemischen Gesellschaft, 24: 3108–3126. DOI:10.1002/cber.189102402151
- ↑ "The Cycloheptatrienylium (Tropylium) Ion" W. von E. Doering, L. H. Knox J. Am. Chem. Soc., 1954, 76 (12), pp 3203–3206 DOI:10.1021/ja01641a027
- ↑ "Aromaticity as a Cornerstone of Heterocyclic Chemistry" Alexandru T. Balaban, Daniela C. Oniciu, Alan R. Katritzky Chem. Rev., 2004, 104 (5), 2777–2812 DOI:10.1021/cr0306790
- ↑ "Cyclopropenyl Cation. Synthesis and Characterization." R. Breslow and J. T. Groves J. Am. Chem. Soc. , 1970, 92 (4), 984–987 [1]
- ↑ N. C. Deno, J. J. Jaruzelski, and Alan Schriesheim (1955) "Carbonium ions. I. An acidity function (C0) derived from arylcarbonium ion equilibria." J. Am. Chem. Soc., 77 (11), 3044–3051. DOI:10.1021/ja01616a036
- ↑ "Stable carbocations. CXVIII. General concept and structure of carbocations based on differentiation of trivalent (classical) carbenium ions from three-center bound penta- of tetracoordinated (nonclassical) carbonium ions. Role of carbocations in electrophilic reactions" George A. Olah Journal of the American Chemical Society; 1972; 94(3) 808–820; DOI:10.1021/ja00758a020
- ↑ "A Quantum Mechanical Investigation of the Orientation of Substituents in Aromatic Molecules" G. W. Wheland Journal of the American Chemical Society; 1942; 64(4) 900–908; DOI:10.1021/ja01256a047
- ↑ A guidebook to mechanism in organic chemistry, Peter Sykes; pp 130–133
- ↑ "Isolating Benzenium Ion Salts" Christopher A. Reed, Kee-Chan Kim, Evgenii S. Stoyanov, Daniel Stasko, Fook S. Tham, Leonard J. Mueller, and Peter D. W. Boyd Journal of the American Chemical Society; 2003; 125(7) 1796–1804; DOI:10.1021/ja027336o
- ↑ Compendium of Chemical Terminology, acyl groups
- ↑ B. Chevrier; J. M. Le Carpentier; R. Weiss. Synthesis of two crystalline species of the Friedel–Crafts intermediate antimony pentachloride-p-toluoyl chloride. Crystal structures of the donor–acceptor complex and of the ionic salt. Journal of the American Chemical Society. 1972, s. 5718–5723.