Cis-cyklookten
| cis-Cyklookten | |
|---|---|
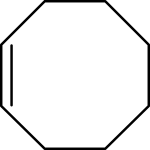 Strukturní vzorec | |
| Obecné | |
| Systematický název | (Z)-cyklookten |
| Sumární vzorec | C8H14 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 931-87-3 |
| EC-no (EINECS/ELINCS/NLP) | 213-243-4 |
| PubChem | 638079 |
| SMILES | C\1=C\CCCCCC/1 |
| InChI | InChI=1S/C8H14/c1-2-4-6-8-7-5-3-1/h1-2H,3-8H2/b2-1- |
| Vlastnosti | |
| Molární hmotnost | 110,20 g/mol |
| Teplota tání | −16 °C (257 K) |
| Teplota varu | 145 až 146 °C (418 až 419 K) |
| Hustota | 0,846 g/cm3 |
| Tlak páry | 0,60 kPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H226 H304[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P280 P301+316 P303+361+353 P331 P370+378 P403+235 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
cis-Cyklookten je cykloalken se vzorcem (CH2)6(CH)2, bezbarvá kapalina používaná na výrobu polymerů a jako ligand v organokovové chemii.
Cyklookten je nejmenším cykloalkenem, u kterého lze izolovat jeho cis- i trans-izomer.[2]
 |
|
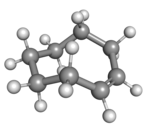
| cis-Cyklookten v židličkové konformaci |
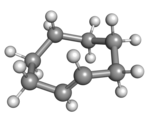
(Rp)-trans-cyklookten v korunové konformaci |
Reakce a použití
[editovat | editovat zdroj]Cyklookten se účastní polymerizací metatezí s otevíráním kruhu za vzniku polyoktenamerů.[3]
cis-Cyklookten vytváří epoxid selektivněji než mnohé jiné cykloalkeny, jako například cyklohexen a vzniká přitom velmi malé množství radikálových vedlejších produktů, což je způsobeno obtížnou funkcionalizací allylových CH center. Za přítomnosti radikálů se tak epoxid tvoří převážně adičně-eliminačním mechanismem.[2]
cis-Cyklookten má využití v organokovové chemii jako snadno odstranitelný ligand, například v dimeru chlorobis(cyklookten)rhodia a dimeru chlorobis(cyklookten)iridia.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku cis-Cyclooctene na anglické Wikipedii.
- ↑ a b c d e https://pubchem.ncbi.nlm.nih.gov/compound/638079
- ↑ a b Ulrich Neuenschwander; Ive Hermans. The Conformations of Cyclooctene: Consequences for Epoxidation Chemistry. The Journal of Organic Chemistry. 2011, s. 10236–10240. DOI 10.1021/jo202176j. PMID 22077196.
- ↑ Lionel Delaude; Alfred F. Noels. Kirk-Othmer Encyclopedia of Chemical Technology.Chybí název periodika! Wiley-VCH, 2005. ISBN 0471238961. DOI 10.1002/0471238961.metanoel.a01.


