Stereoizomerie
Jako stereoizomerie se označuje jev, kdy mají dvě izomerní molekuly stejný sumární vzorec a stejné pořadí funkčních skupin, ovšem liší se v prostorovém umístění těchto skupin;[1] tím se liší od strukturních izomerů, které mají stejný sumární vzorec, ale různé funkční skupiny. Podle definice tedy může jeden strukturní izomer mít více stereoizomerů.
Druhy stereoizomerů
Enantiomery
Enantiomery (také nazývané jako optické izomery) jsou dva stereoizomery, které se od sebe liší optickou otáčivostí, navzájem jsou zrcadlovými obrazy. Každá odpovídající si stereocentra takových molekul mají navzájem opačné konfigurace. Dvě látky, které jsou vůči sobe enantiomery, mají shodné fyzikální vlastnosti s výjimkou směru, kterým stáčejí rovinu polarizovaného světla a způsobu interakce s enantiomery ostatních sloučenin. Rozdílné enantiomery téže sloučeniny tedy mohou mít značně odlišné biologické účinky. Enantiomery lze od sebe oddělit pouze pomocí chirálního činidla. V přírodě se většina chirálních biomolekul, například aminokyselin (kromě nechirálního glycinu) vyskytuje pouze jako jeden z enantiomerů.
Diastereomery
Diastereomery jsou stereoizomery, které nejsou vzájemnými zrcadlovými obrazy. Patří sem mesosloučeniny, cis–trans (E-Z) a neenantiomerní optické izomery. Látky, které jsou nazvájem diastereomery, mají rozdílné fyzikální vlastnosti. V níže zobrazeném příkladě meso forma kyseliny vinné tvoří diastereomerní dvojici s kyselinou L-vinnou i s kyselinou D-vinnou.
Cis–trans izomery
Stereoizomerie kolem dvojných vazeb vzniká, protože zde nemůže dojít k rotaci kolem vazby a substituenty tak zůstávají na stejném místě. Pokud jsou substituenty alespoň na jednom atomu, ze kterých vychází dvojná vazba, na obou stranách stejné, pak sloučenina nevytváří stereoizomery a dvojná vazba není stereocentrem; příkladem je propen, kdy jsou oba substituenty na jednom konci atomy vodíku.
Stereoizomery na dvojných vazbách se označují cis (pokud jsou substituenty na stejné straně od dvojné vazby) nebo trans (pokud jsou na opačných stranách); používá se také značení Z (u cis izomerů) a E (u trans izomerů). Nejjednoduššími příklady jsou 1,2-disubstituované deriváty ethenu, jako je 1,2-dichlorethen, jehož izomery jsou zobrazeny na následujícím obrázku:
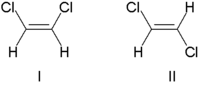
Molekula I je cis-1,2-dichlorethen a molekula II je trans-1,2-dichlorethen.
Konformery
Konformery jsou izomery, které mají stejný strukturní vzorec, ale kvůli rotaci kolem jedné či více jednoduchých vazeb se liší tvarem molekuly. Různé konformace mají různé energie, často se mezi sebou přeměňují a málokdy je lze od sebe oddělit.
Mnoho různých konformací vytváří například cyklohexan.
Anomery
Anomery jsou cyklické molekuly s jednoduchými vazbami, u kterých je k pojmenování substituentů na uhlíkovém atomu určit, zda je o cis- nebo trans izomer. Typ anomeru se určuje podle polohy hydroxylové skupiny (-OH) na prvním uhlíku, když je u D cukru -OH v Haworthově projekci dole (tedy vpravo v projekci Tollensově), pak je daná molekula α izomerem. Je-li u D cukru -OH nahoře (tedy vlevo v Tollensově projekci), jedná se o β izomer. U L cukrů se postupuje obráceně.
Atropizomery
Atropizomery jsou stereoizomery, které se objevují při prostorově znemožněné rotaci kolem jednoduché vazby; energie sterické bariéry je tak vysoká, že umožňuje izolaci jednotlivých konformerů.
Reference
Externí odkazy
 Obrázky, zvuky či videa k tématu stereoizomerie na Wikimedia Commons
Obrázky, zvuky či videa k tématu stereoizomerie na Wikimedia Commons
