Tosyl


Tosyl (zkráceně Ts nebo Tos) je označení funkční skupiny se vzorcem CH3C6H4SO2. Tato skupina je často odvozována od tosylchloridu (zkráceně TsCl), který tvoří estery a amidy kyseliny p-toluensulfonové. Para-umístění je nejčastější, proto se podle dohody tímto názvem označuje p-toluensulfonylová skupina.
Tosylát (příp. ve farmaceutických INN názvech tosilát) je označení aniontu kyseliny p-toluensulfonové (CH3C6H4SO -
3 , zkráceně TsO−), jako tosyláty se též označují její estery.
Použití[editovat | editovat zdroj]
Pro SN2 reakce mohou být alkanoly převedeny na alkyltosyláty, většinou přidáním tosylchloridu. V této reakci volný elektronový pár alkoholového kyslíku atakuje síru v tosylchloridu, odstraní chloridovou skupinu a vytvoří tosylát. Toto převedení je užitečné, jelikož alkoholy jsou oproti tosylátům méně vhodné pro SN2 reakce. Přeměna alkanolů na alkyltosyláty je tím, co umožňuje, aby SN2 reakce proběhla za přítomnosti dobrého nukleofilu.
Tosylová skupina se používá jako chránicí skupina v organické syntéze. Alkoholy mohou být převedeny na tosyláty, čímž se zamezí některým reakcím. Tosyláty lze později znovu převést na alkoholy. Příkladem může být syntéza léčiva tolterodinu, kde je fenolová skupina při jednom z kroků chráněna jako tosylát a primární alkohol jako nosylát:
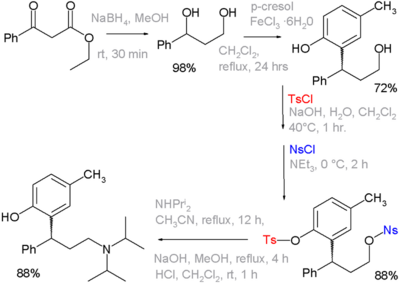
Tosyl lze též použít jako chránicí skupinu pro aminy. Vzniklá sulfonamidová skupina je velmi stabilní. Zpět na amin se převádí použitím redukčního činidla nebo silné kyseliny.[1]
Ochrana aminů[editovat | editovat zdroj]
Nejčastější ochranné metody[editovat | editovat zdroj]
Nejčastější způsoby odstranění chránicí skupiny[editovat | editovat zdroj]
- HBr a kyselina octová při 70 °C.[3]

Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Tosyl na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tosyl na Wikimedia Commons
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Tosyl na anglické Wikipedii.
- ↑ GREENE, T. W.; WUTS, P. G. M. Protective Groups In Organic Synthesis. New York: John Wiley & Sons, 1999. ISBN 9780471160199. S. 603–607.
- ↑ WUTS, Peter G. M.; GREENE, Theodora W. Greene's Protective Groups in Organic Synthesis, Fourth Edition - Wuts - Wiley Online Library. [s.l.]: [s.n.] Dostupné online. DOI 10.1002/0470053488.
- ↑ HASKELL, Betty E.; BOWLUS, Stephen B. New synthesis of L-2-amino-3-oxalylaminopropionic acid, the Lathyrus sativus neurotoxin. The Journal of Organic Chemistry. 1976-01-01, s. 159–160. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo00863a042.
