Petersonova olefinace
Petersonova olefinace (také nazývaná Petersonova reakce) je reakce α-silylkarboaniontů (1 na níže uvedeném obrázku) s aldehydy nebo ketony za vzniku β-hydroxysilanů (2) a následné eliminace na alken.
Bylo vydáno několik studií zabývajících se touto reakcí.[1][2][3][4][5]
Mechanismus[editovat | editovat zdroj]
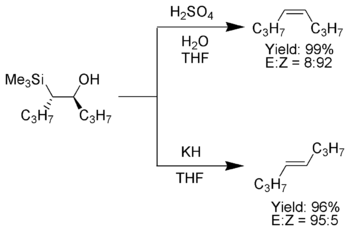
Petersonovu reakci lze použít na přípravu cis- i trans-alkenů ze stejného β-hydroxysilanu. Jeho reakcí s kyselinou vznikne jeden izomer alkenu a reakcí se zásadou opačný.
Zásaditá eliminace[editovat | editovat zdroj]
Reakcí zásady s β-hydroxysilanem (1) dojde k syn-eliminaci látky 2 nebo 3 za vzniku alkenu. Předpokládá se tvorba pentakoordinovaného meziproduktu 3, která však nebyla prokázána.

Nejrychleji reakce probíhá s draselnými alkoxidy, zatímco při použití sodných alkoxidů je obvykle potřeba reakční směs zahřívat. Hořečnaté alkoxidy reagují jen za extrémních podmínek. Pokles reaktivity v řadě K > Na >> Mg je v souladu s větší elektronovou hustotou na atomu kyslíku a tedy i větší nukleofilitou.
Kyselá eliminace[editovat | editovat zdroj]
Reakcí β-hydroxysilanu (1) s kyselinou dojde k protonaci a vzniku alkenu po anti-eliminaci.

Vliv alkylových substituentů[editovat | editovat zdroj]
Pokud α-silylový karbanion obsahuje pouze alkylové, vodíkové nebo elektrony dodávající substituenty, tak lze stereochemii produktů Petersonovy reakce ovládat,[6] protože při nízké teplotě eliminace probíhá pomalu a β-hydroxysilanový meziprodukt lze izolovat.
Po izolaci se oddělí jednotlivé diastereomery β-hydroxysilanu. Jeden se nechá zreagovat s kyselinou a druhý se zásadou, což vede ke vzniku alkenu s požadovanou stereochemií.[3]
Substituenty snižující elektronovou hustotu[editovat | editovat zdroj]
Jsou-li na α-silylový karbanion navázány elektronakceporní substituenty, tak vznikne přímo alken a β-hydroxysilan nelze izolovat. Tyto reakce probíhají v zásaditém prostředí.
Obměny[editovat | editovat zdroj]
Reakční podmínky kyselé eliminace jsou často nevhodné z hlediska toho, že kyselina také katalyzuje izomerizaci na dvojné vazbě. Eliminace za přítomnosti hydridu sodného nebo draselného také nelze provádět u reaktantů s určitými funkčními skupinami. Bylo zjištěno, že acylací silylkarbinolového meziproduktu acetylchloridem nebo thionylchloridem se tvoří β-silylový ester, který se při 25 °C samovolně eliminuje na výsledný alkan.[7] Byla také vyvinuta metoda někdy zvaná Coreyova-Petersonova olefinace, při které se používají silylované iminy na přípravu α,β-nenasycených aldehydů z karbonylových sloučenin v jediném kroku.[8]
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Petersonova olefinace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Petersonova olefinace na Wikimedia Commons
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Peterson olefination na anglické Wikipedii.
- ↑ Birkofer, L.; Stiehl, O. Top. Curr. Chem. 1980, 88, 58. (Review)
- ↑ Ager, D. J. Synthesis 1984, 384–398. (Review)
- ↑ a b Ager, D. J. Organic Reactions 1990, 38, 1. DOI:10.1002/0471264180.or038.01
- ↑ New developments in the Peterson olefination reaction L. Frances van Staden, David Gravestock and David J. Ager Chemical Society Reviews, 2002,31, 195-200 DOI:10.1039/A908402I
- ↑ T. H. Chan. Alkene synthesis via β-functionalized organosilicon compounds. Accounts of Chemical Research. 1977, s. 442–448. DOI 10.1021/ar50120a003.
- ↑ BARRETT, A. G. M.; FLYGARE, J. A.; HILL, J. M.; WALLACE, E. M. Stereoselective Alkene Synthesis via 1-Chloro-1-[(dimethyl)phenylsilyl]alkanes and α-(Dimethyl)phenylsilyl Ketones: 6-Methyl-6-dodecene. Org. Synth.. 1998. Dostupné online.; Coll. Vol.. S. 580.
- ↑ T. H. Chan; E. Chang. Synthesis of alkenes from carbonyl compounds and carbanions alpha to silicon. III. Full report and a synthesis of the sex pheromone of gypsy moth. The Journal of Organic Chemistry. 1974, s. 3264–3268. DOI 10.1021/jo00936a020.
- ↑ X. Zeng; F. Zeng; E. Negishi. Efficient and Selective Synthesis of 6,7-Dehydrostipiamide via Zr-Catalyzed Asymmetric Carboalumination and Pd-Catalyzed Cross-Coupling of Organozincs. Organic Letters. 2004, s. 3245–3248. DOI 10.1021/ol048905v. PMID 15355023.

