Hydrogenšťavelan sodný
| Hydrogenšťavelan sodný | |
|---|---|
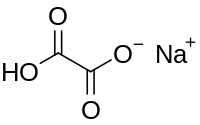 Strukturní vzorec | |
| Obecné | |
| Systematický název | hydrogenšťavelan sodný |
| Funkční vzorec | HOOCCOO−Na+ |
| Sumární vzorec | C2HO4Na |
| Identifikace | |
| Registrační číslo CAS | 1186-49-8 |
| EC-no (EINECS/ELINCS/NLP) | 214-691-3 |
| PubChem | 23684893 |
| SMILES | [Na+].[O-]C(=O)C(=O)O |
| InChI | 1S/C2H2O4.Na/c3-1(4)2(5)6;/h(H,3,4)(H,5,6);/q;+1/p-1 |
| Vlastnosti | |
| Molární hmotnost | 112,02 g/mol |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H312[1] |
| P-věty | P264 P270 P280 P301+317 P302+352 P317 P321 P330 P362+364 P501[1] |
Některá data mohou pocházet z datové položky. | |
Hydrogenšťavelan sodný je sůl kyseliny šťavelové se vzorcem HOOCCOO−Na+, patřící mezi hydrogenšťavelany.
Vlastnosti[editovat | editovat zdroj]
Tvorba hydrátu[editovat | editovat zdroj]
Hydrogenšťavelan sodný se vyskytuje v bezvodé podobě či jako monohydrát (HOOCCOO−Na+·H2O); v obou případech jde o bezbarvé pevné látky.
Monohydrát lze získat odpařením sloučeniny z roztoku za pokojové teploty.[2]
Krystaly NaHC2O4·H2O jsou trojklonné, s mřížkovými konstantami a = 650,3 pm, b = 667,3 pm, c = 569,8 pm, α = 85,04°, β = 110,00°, γ = 105,02° a Z = 2. Hydrogenšťavelanové ionty jsou svými konci propojeny do řetězců vodíkových vazeb (o délce 257,1 pm). Řetězce jsou překřížené a vytváří vrstvy vazeb O–H···O s molekulami vody (280,8 pm, 282,6 pm) a iontovými vazbami Na+···O. Hydrogenšťavelanové skupiny nejsou rovinné, vykazují pootočení kolem vazeb C–C o 12,9°.[3]
Reakce[editovat | editovat zdroj]
Po zahřátí se hydrogenšťavelan sodný mění na kyselinu šťavelovou a šťavelan sodný, přičemž šťavelan se dále rozkládá na uhličitan sodný a oxid uhelnatý.[4]
- 2 NaHC2O4 → Na2C2O4 + H2C2O4
- Na2C2O4 → Na2CO3 + CO
Toxicita[editovat | editovat zdroj]
Nebezpečí spojená s touto sloučeninou jsou způsobena převážně její kyselostí a vlastnostmi šťavelové a dalších šťavelanů a hydrogenšťavelanů, projevují se po pozření nebo absorpci kůží. K následkům patří nekróza tkání kvůli chelataci vápenatých iontů a tvorba nerozpustného šťavelanu vápenatého v ledvinách, kde poté může dojít k ucpání ledvinových kanálků.[5]
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Sodium hydrogenoxalate na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/23684893
- ↑ C. Ramki, R. Ezhil Vizhi (2017): Growth, optical, electrical and mechanical properties of sodium hydrogen oxalate hydrate (NaHC2O4·H2O) single crystal for NLO applications Materials Chemistry and Physics, volume 197, pages 70-78 DOI:10.1016/j.matchemphys.2017.04.066
- ↑ Roland Tellgren and Ivar Olovsson (1971): "Hydrogen Bond Studies. XXXXVI. The Crystal Structures of Normal and Deuterated Sodium Hydrogen Oxalate Monohydrate NaHC2O4·H2O and NaDC2O4·D2O". Journal of Chemical Physics, volume 54, issue 1 DOI:10.1063/1.1674582
- ↑ W. Balcerowiak; C. Latocha; J. Wasilewski. Thermoanalytical investigation of mixtures containing oxalic acid, sodium hydrogen oxalate and sodium oxalate. Journal of Thermal Analysis. 1980, s. 57–63. DOI 10.1007/BF01909453.
- ↑ Monosodium oxalate

