Disproporcionace radikálů
Disproporcionace radikálů jsou organické reakce, kde dva radikály vytváří dva neradikálové produkty. Vzhledem k vysoké reaktivitě radikálů probíhají rychle a mají velmi nízké aktivační energie.[1] Nejvíce prozkoumané jsou u alkylových radikálů, ale mohou probíhat i u jiných molekul, často vícestupňově.
Mechanismus[editovat | editovat zdroj]
Při disproporcionacích radikálů jedna molekula slouží jako akceptor a druhá jako donor.[2] Při nejobvyklejším druhu se odštěpí vodík z donoru za eliminace a vzniku dvojné vazby.[3] Odštěpovat se mohou i jiné atomy, například halogeny.[4]

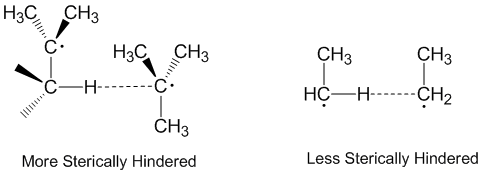
Sterické efekty[editovat | editovat zdroj]
Disproporcionace radikálů se často popisují jako lineární reakce, což ale ve většině případů neplatí.[2] U stericky zatížených molekul vyžadují lineární uspořádání a reagují tak pomaleji. Ethylové radikály jsou lepšími akceptory než terc-butylové,[5] kde sterické efekty znesnadňují přibližování vodíků.[6]
Disproporcionace alkylových radikálů[editovat | editovat zdroj]
Disproporcionace alkylových radikálů jsou podrobně prozkoumané.[6] Konečnými produkty každé takové reakce jsou molekula alkanu a alkenu a řád vazby se zvyšuje o 1;[1] reakce je tak exotermní (ΔH = 2000 – 400 kJ/mol) a rychlá.[6]
Křížové disproporcionace[editovat | editovat zdroj]
Ke křížovým disproporcionacím dochází při reakcích dvou různých alkylových radikálů. Podle toho, který radikál je donorem a který akceptorem, mohou vznikat rozdílné produkty. Donorové vlastnosti primárních a sekundárních alkylových radikálů závisí na sterických efektech a konfiguraci u akceptorů.[3]
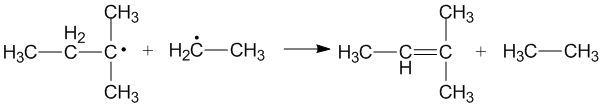
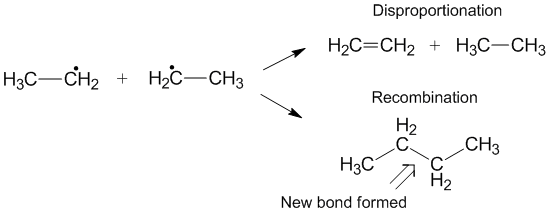
Rekombinace[editovat | editovat zdroj]
Vedle disproporcionací mohou probíhat také rekombinace,[6] kdy dva radikály utvoří jeden neradikálový produkt a jednu novou vazbu; u alkylových radikálů mnohdy převažují. Podobně jako u disproporcionace jsou rekombinace exotermní a mají nízké aktivační energie. Poměr rychlosti disproporcionace a rekombinace se značí kD/kC. S nárůstem počtu přenositelných vodíků se tento poměr posouvá ve prospěch disproporcionace.[3]
Kinetický izotopový efekt[editovat | editovat zdroj]
Po nahrazení atomů vodíku v alkylovém radikálu deuteriem je disproporcionace o něco pomalejší, zatímco rychlost rekombinace se nemění; disproporcionace je tak mírně ovlivňována kinetickým izotopovým efektem, kdy kH/kD je u ethenu rovno 1,20 ± 0´,15.[7] Vodíky a deuterony se rekombinací neúčastní, ale oddělení deuteronu při disproporcionaci je v důsledku vyšší hmotnosti a nižší vibrační energie pomalejší než u lehkého vodíku, přestože je pozorovaná hodnota kH/kD blízká jedné.
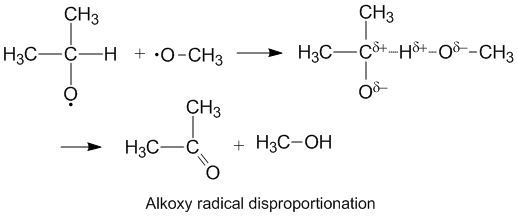
Polární efekty a disproporcionace alkoxyradikálů[editovat | editovat zdroj]
Alkoxyradikály, mající nepárový elektron na atomu kyslíku, mívají vyšší kD/kC než alkylové radikály. Na kyslíku se nachází částečný záporný náboj, čímž se snižuje elektronová hustota na donorovém uhlíku a usnadňuje oddělování vodíku. Rychlost disproporcionace zvyšuje také skutečnost. že kyslík navázaný na akceptor má vyšší elektronegativitu než uhlík.[6]
Terminace řetězových reakcí[editovat | editovat zdroj]
Řada radikálových reakcí probíhá řetězově, přičemž se disproporcionace a rekombinace objevují v závěrečném kroku.[8] Disproporcionace a rekombinace brání prodlužování řetězce.[8] Omezením disproporcionace a rekombinace v závěru reakce má velký význam při polymerizacích. U některých reakcí jim lze zabránit sterickými efekty nebo efekty rozpouštědla.[9]
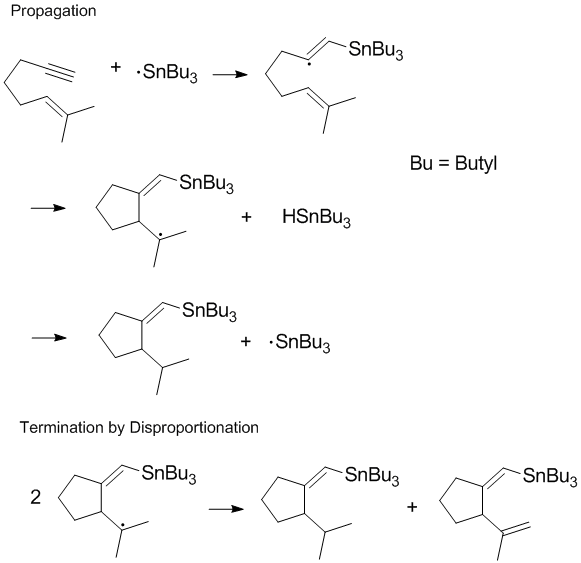
Omezení disproporcionace v živých radikálových polymerizacích[editovat | editovat zdroj]
I když může disproporcionace vytvořit novou dvojnou vazbu, která se poté může zapojit do dalších reakcí s polymerním řetězcem, tak se při ní také vytváří nasycený uhlovodík, což omezuje řetězovou reakci.[10] Při živých radikálových polymerizacích k terminacím nedochází; tohoto lze dosáhnout několika způsoby, například vratnou terminací se stabilními radikály. Omezení rekombinace a disproporcionace se dá dosáhnout pomocí nitroxidových radikálů.[11]

Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Radical disproportionation na anglické Wikipedii.
- ↑ a b Thommarson, R. L. Journal of Physical Chemistry, 1970, 74, 938-941 DOI:10.1021/j100699a046
- ↑ a b Benson, Sidney W. Journal of Physical Chemistry, 1985, 89, 4366-4369 DOI:10.1021/j100266a042
- ↑ a b c Kelley, Richard D., Klein, Ralph. Journal of Physical Chemistry, 1974, 78, 1586-1595 DOI:10.1021/j100609a004
- ↑ Setser, D. W., Muravyov, A. A., Rengarajan, R. Journal of Physical Chemistry, 2004, 108, 3745-3755 DOI:10.1021/jp031144d
- ↑ Fischer, Hans. Chemical Reviews, 2001, 101, 3581-3610 DOI:10.1021/cr990124y
- ↑ a b c d e Gibian, Morton J. and Robert C. Corley. Chemical Reviews, 1973, 73, 441-464 DOI:10.1021/cr60285a002
- ↑ Fahr, Askar, Laufer, Allan H. Journal of Physical Chemistry, 1995, 99, 262-264 DOI:10.1021/j100001a040
- ↑ a b Matyjaszewski, Krysztof, Xia, Jianhui. Chemical Reviews, 2001, 101, 2921-2990 DOI:10.1021/cr940534g
- ↑ Miura, Katsukiyo, Saito, Hiroshi, Fujisawa, Naoki, Hosomi, Akira. The Journal of Organic Chemistry, 2000, 65, 8119-8122 DOI:10.1021/jo005567c
- ↑ Dias, Rolando C. S., Costa, Mario Rui P. F. N. Macromolecules, 2003, 36, 8853-8863 DOI:10.1021/ma035030b
- ↑ Kruse, Todd M., Souleimonova, Razima, Cho, Andrew, Gray, Maisha K., Torkelson, John M., Broadbelt, Linda J. Macromolecules, 2003, 36, 7812-7823 DOI:10.1021/ma030091v
