Trimethylenmethan
| Trimethylenmethan | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | 2-methylidenpropan-1,3-diyl |
| Sumární vzorec | C4H6 |
| Identifikace | |
| Registrační číslo CAS | 106-93-4 |
| EC-no (EINECS/ELINCS/NLP) | 203-444-5 |
| PubChem | 11790068 |
| SMILES | [CH2-]C(=C)[CH2+] |
| InChI | InChI=1S/C4H6/c1-4(2)3/h1-3H2 |
| Vlastnosti | |
| Molární hmotnost | 54,090 g/mol |
Některá data mohou pocházet z datové položky. | |
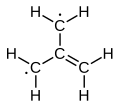
Trimethylenmethan (zkráceně TMM) je organická sloučenina se vzorcem C4H6, elektricky nenabitá molekula patřící mezi radikály, kterou lze považovat za odvozenou od isobutenu (C4H8) odtržením dvou vodíkových atomů z koncových methylových skupin.
Struktura
[editovat | editovat zdroj]Elektronová struktura trimethylenmethanu byla poprvé popsána v roce 1948.[1][2] Tato čtyřuhlíkatá molekula obsahuje čtyři molekulové orbitaly typu π. Při zachycení v pevné matrici za teplot okolo 90 K (-183 °C) je všech šest vodíkových atomů molekuly rovnocenných, látku tak lze popsat jako zwitterion, nebo jako nejjednodušší konjugovaný uhlovodík bez Kekulovské struktury. Vyskytuje se v rovnováze mezi těmito třemi strukturami:

|

|
|
Základní stav trimethylenmethanu je tripletový (3A2′/3B2), a látka je tedy diradikálem.[3]
Výpočty byl zjištěn rovinný tvar s trojčetnou rotační symetrií a délkami vazeb přibližně 140 pm (C–C) a 108 pm (C–H). Úhly H–C–H v methylenových skupinách činí 121°.[1]
První singletový excitovaný stav, 11A1 (1,17 eV nad základním stavem), je diradikálem s rovinnou geometrií a plně degenerovanou trojitou (D3h) symetrií. Druhý, 11B2 (také o energii 1,17 eV), vykazuje D3h-symetrickou rovnováhu mezi trojicí ekvivalentních geometrií; každá z nich má jednu vazbu C–C delší (148 pm) a dvě kratší (138 pm), a je rovinná a dvoustranně symetrická, s odchylkou v podobě vybočení methylenu z roviny o 79° (C2 symetrie). Třetí singlet, 21A1/1A1′ (3,88 eV), tvoří rovnováhu tří D3h-symetrických rovinných geometrií, kde má každá jednu vazbu C–C kratší a dvě delší (C2ν symetrie).[1]
Dalšímu stavy o vyšších energiích jsou degenerované triplety, 13A1 a 23B2 (4,61 eV), s jedním excitovaným elektronem; a kvintetový stav, 5B2 (7,17 eV), kde jsou orbitaly p obsazeny pokaždé jedním elektronem, se symetrií typu D3h.[1]
Příprava
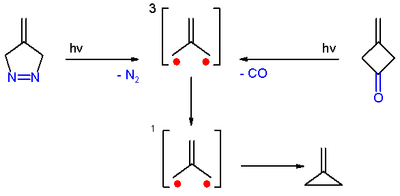
[editovat | editovat zdroj]Trimethylenmethan byl poprvé připraven fotolýzou diazosloučeniny 4-methylen-Δ1-pyrazolinu za odštěpení dusíku, ve zmrazeném zředěném roztoku při -196 °C.[3]
Lze jej také získat fotolýzou 3-methylencyklobutanonu, ve chladném roztoku i krystalického, s odštěpením oxidu uhelnatého. Vzniklý trimethylenmethan je možné v obou uvedených případech detekovat elektronovou paramagnetickou rezonancí.[3]
Další možností přípravy trimethylenmethanu je reakce kovového draslíku s 2-jodmethyl-3-jodpropenem a plynným dijodizobutenem (IH2C)2C=CH2; produkt se ale rychle dimerizuje na 1,4-dimethylencyklohexan a vzniká také 2-methylpropen odštěpením dvou vodíkových atomů z dalších molekul (uhlovodíků nebo hydridu draselného).[4]
Organokovové sloučeniny
[editovat | editovat zdroj]Trimethylenmethan vytváří organokovové komplexy, jako například Fe(C4H6)(CO)3, který se připravuje otevíráním kruhu methylencyklopropanu nonakarbonylem diželeza (Fe2(CO)9).[3] Získat se tento komplex dá též podvojnou záměnou z tetrakarbonylželeznatanu sodného (Na2Fe(CO)4) a 1,1-bis(chlormethyl)ethenu (H2C=C(CH2Cl)2)[5] Obdobnými reakcemi vznikají také komplexy M(TMM)(CO)4 (M = Cr, Mo). Reakce vytvářející Mo(TMM)(CO)4 také vytváří Mo(C8H12)(CO)3, obsahující dimerizovaný TMM ligand.[5]
Komplexy TMM mají využití v organické syntéze při trimethylenmethanových cykloadicích, jako je palladiem katalyzovaná [3+2] cykloadice trimethylenmethanu.[6]

Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Trimethylenemethane na anglické Wikipedii.
- ↑ a b c d Lyudmila V. Slipchenko; Anna I. Krylov. Electronic structure of the trimethylenemethane diradical in its ground and electronically excited states: Bonding, equilibrium geometries, and Vibrational frequencies. Journal of Chemical Physics. 2003, s. 6874-6883. DOI 10.1063/1.1561052. Bibcode 2003JChPh.118.6874S.
- ↑ C. A. Coulson (1948), Journal de Chimie Physique et de Physico-Chimie Biologique, volume 45, page 243
- ↑ a b c d Paul Dowd. Trimethylenemethane. Accounts of Chemical Research. 1972, s. 242-248. DOI 10.1021/ar50055a003.
- ↑ Philip S. Skell; Robert G. Doerr. Trimethylenemethane. Journal of the American Chemical Society. 1967, s. 4688–4692. DOI 10.1021/ja00994a020.
- ↑ a b J. S. Ward; R. Pettit. Trimethylenemethane complexes of iron, molybdenum, and chromium. Journal of the Chemical Society D. 1970, s. 1419–1420. DOI 10.1039/C29700001419.
- ↑ Barry M. Trost. New conjunctive reagents. 2-Acetoxymethyl-3-allyltrimethylsilane for methylenecyclopentane annulations catalyzed by palladium(0). Journal of the American Chemical Society. 1979, s. 6429–6432. DOI 10.1021/ja00515a046.
- ↑ G. E. Herberich; T. P. Spaniol. Trimethylenemethane Complexes of Ruthenium, Osmium and Rhodium Via the Compound CH2=C(CH2SnMe3)2. Journal of the Chemical Society, Dalton Transactions. 1993, s. 2471–2476. DOI 10.1039/DT9930002471.
