Valenční elektron: Porovnání verzí
m editace uživatele 185.74.60.114 (diskuse) vráceny do předchozího stavu, jehož autorem je OJJ značka: rychlé vrácení zpět |
přidání odkazů značky: revertováno editace z Vizuálního editoru |
||
| Řádek 1: | Řádek 1: | ||
[[Soubor:Atom.svg|right|thumb|[[Atom]] [[helium|helia]] se skládá ze 2 [[proton]]ů, 2 [[neutron]]ů a 2 [[elektron]]ů. Elektrony v jeho valenční (jediné) vrstvě jsou elektrony valenční. Elektrony jsou pro názornost zobrazeny jako částice obíhající kolem jádra po konkrétní dráze – orbitu.]] |
[[Soubor:Atom.svg|right|thumb|[[Atom]] [[helium|helia]] se skládá ze 2 [[proton]]ů, 2 [[neutron]]ů a 2 [[elektron]]ů. Elektrony v jeho valenční (jediné) vrstvě jsou elektrony valenční. Elektrony jsou pro názornost zobrazeny jako částice obíhající kolem jádra po konkrétní dráze – orbitu.]] |
||
'''Valenční elektron''' je [[elektron]] v [[elektronový obal|elektronovém obalu]] umístěný v energeticky nejvýše položené (valenční) vrstvě (příp. několika vrstvách). Jde tedy o elektrony z posledních, největších, orbitalů v rámci elektronové konfigurace atomu. Orbitaly obsahující valenční elektrony se nazývají valenční orbitaly. Tyto elektrony (resp. orbitaly) přijdou nejsnáze do kontaktu s jinými atomy a jejich valenčními elektrony (orbitaly), a díky tomu se mohou podílet na vzniku [[chemická vazba|chemických vazeb]] mezi [[atom]]y. [[Elektronová konfigurace]] valenčních elektronů je pak z hlediska chemie nejdůležitější charakteristika atomu konkrétního prvku. Počet elektronů ve valenční slupce je specifický pro daný [[chemický prvek]] – podle něj jsou prvky rozděleny do sloupců [[periodická tabulka|periodické tabulky]] – ty se označují jako skupiny. Počet valenčních elektronů většinou určuje maximální [[oxidační číslo]] atomu. Skupiny prvků v periodické soustavě byly klasicky číslovány I.A až VIII.A a I.B až VIII.B – zde číslo skupiny odpovídalo počtu valenčních elektronů (s výjimkou části skupiny VIII.B a skupin I.B a II.B). Modernější očíslování skupin 1 až 18 s počtem valenčních elektronů souvisí jen u menší části prvků. |
'''Valenční elektron''' je [[elektron]] v [[elektronový obal|elektronovém obalu]] umístěný v energeticky nejvýše položené (valenční) vrstvě (příp. několika vrstvách). Jde tedy o elektrony z posledních, největších, orbitalů v rámci elektronové konfigurace atomu. Orbitaly obsahující valenční elektrony se nazývají valenční orbitaly. Tyto [[Elektron|elektrony]] (resp. orbitaly) přijdou nejsnáze do kontaktu s jinými atomy a jejich valenčními elektrony (orbitaly), a díky tomu se mohou podílet na vzniku [[chemická vazba|chemických vazeb]] mezi [[atom]]y. [[Elektronová konfigurace]] valenčních elektronů je pak z hlediska chemie nejdůležitější charakteristika atomu konkrétního prvku. Počet elektronů ve valenční slupce je specifický pro daný [[chemický prvek]] – podle něj jsou prvky rozděleny do sloupců [[periodická tabulka|periodické tabulky]] – ty se označují jako skupiny. Počet valenčních elektronů většinou [[určuje]] maximální [[oxidační číslo]] [[Atom|atomu]]. Skupiny prvků v periodické soustavě byly klasicky číslovány I.A až VIII.A a I.B až VIII.B – zde číslo skupiny odpovídalo počtu valenčních elektronů (s výjimkou části skupiny VIII.B a skupin I.B a II.B). Modernější očíslování skupin 1 až 18 s počtem valenčních elektronů souvisí jen u menší části prvků. |
||
[[Soubor:Atomic orbital diagonal rule.svg|náhled|[[Elektronová konfigurace#Výstavbový princip|Výstavbový princip]] může u atomu zjednodušeně vyjádřit všechna [[kvantové číslo|kvantová čísla]]. Pokud chceme u atomu všechna tato čísla vyjádřit, sečteme číslo n s počtem elektronů. Dokud má vrstva kapacitu (podle údajů viz vlevo), postupujeme podle šipek této tabulky.]] |
[[Soubor:Atomic orbital diagonal rule.svg|náhled|[[Elektronová konfigurace#Výstavbový princip|Výstavbový princip]] může u atomu zjednodušeně vyjádřit všechna [[kvantové číslo|kvantová čísla]]. Pokud chceme u atomu všechna tato čísla vyjádřit, sečteme číslo n s počtem elektronů. Dokud má vrstva kapacitu (podle údajů viz vlevo), postupujeme podle šipek této tabulky.]] |
||
Chemické prvky se dělí na ''[[blok s|s]]'', ''[[blok p|p]]'', ''[[přechodné kovy|d]]'' a ''[[vnitřně přechodné kovy|f-prvky]]'' podle umístění jejich valenčních elektronů v orbitalech. Prvky ''s'' a ''p'' se také nazývají nepřechodné prvky, jejich valenční elektrony (nebo orbitaly) jsou pouze v jediné – poslední vrstvě (slupce) obalu atomu – jde o skupiny I.A (1) až VIII.A (17) a počet valenčních elektronů (orbitalů) těchto prvků odpovídá číslu skupiny. Jako přechodné prvky se označují ''d-prvky''. Jejich valenční elektrony (orbitaly) zahrnují poslední a část předposlední vrstvy obalu atomu, jde o skupiny I.B až VIII.B (3 až 10). Zde číslo skupiny odpovídá počtu valenčních elektronů jen u části prvků. Jako vnitřně přechodné se označují f-prvky, které mají valenční elektrony (orbitaly) v posledních třech vrstvách obalu atomu. Obecně je elektronová konfigurace valenčních elektronů s-prvků ns<sup>1,2</sup>, p-prvků ns<sup>2</sup>, np<sup>1 až 6</sup>, d-prvků ns<sup>2</sup>, (n–1)d<sup>1 až 10</sup>, kde n je číslo poslední vrstvy obalu atomu (číslo periody, v níž je prvek v periodické soustavě prvků, nejvyšší hodnota kvantového čísla orbitalů daného atomu). Rozdělení prvků za pomoci typu valenčních orbitalů je možné konkretizovat až na označení jednotlivých skupin (sloupců) prvků periodické soustavy. Jsou tak známy s<sup>1</sup> a s<sup>2</sup> prvky, p<sup>1</sup> až p<sup>6</sup> prvky, d<sup>1</sup> až d<sup>10</sup> prvky a f<sup>1</sup> až f<sup>14</sup> prvky. |
Chemické prvky se dělí na ''[[blok s|s]]'', ''[[blok p|p]]'', ''[[přechodné kovy|d]]'' a ''[[vnitřně přechodné kovy|f-prvky]]'' podle umístění jejich valenčních elektronů v orbitalech. Prvky ''s'' a ''p'' se také nazývají nepřechodné prvky, jejich valenční elektrony (nebo orbitaly) jsou pouze v jediné – poslední vrstvě (slupce) obalu atomu – jde o skupiny I.A (1) až VIII.A (17) a počet valenčních elektronů (orbitalů) těchto prvků odpovídá číslu skupiny. Jako přechodné prvky se označují ''d-prvky''. Jejich valenční elektrony (orbitaly) zahrnují poslední a část předposlední vrstvy obalu atomu, jde o skupiny I.B až VIII.B (3 až 10). Zde číslo skupiny odpovídá počtu valenčních elektronů jen u části prvků. Jako vnitřně přechodné se označují f-prvky, které mají valenční elektrony (orbitaly) v posledních třech vrstvách obalu atomu. Obecně je [[elektronová konfigurace]] valenčních elektronů s-prvků ns<sup>1,2</sup>, p-prvků ns<sup>2</sup>, np<sup>1 až 6</sup>, d-prvků ns<sup>2</sup>, (n–1)d<sup>1 až 10</sup>, kde n je číslo poslední vrstvy obalu atomu (číslo periody, v níž je prvek v periodické soustavě prvků, nejvyšší hodnota kvantového čísla orbitalů daného atomu). Rozdělení prvků za pomoci typu valenčních orbitalů je možné konkretizovat až na označení jednotlivých skupin (sloupců) prvků periodické soustavy. Jsou tak známy s<sup>1</sup> a s<sup>2</sup> prvky, p<sup>1</sup> až p<sup>6</sup> prvky, d<sup>1</sup> až d<sup>10</sup> prvky a f<sup>1</sup> až f<sup>14</sup> prvky. |
||
Valenční elektrony může atom prvku potenciálně použít pro tvorbu chemické vazby. Hlavní typ chemické vazby – [[kovalentní vazba]] – se vytváří především s využitím nespárovaných valenčních elektronů, tedy těch, které jsou ve valenčních orbitalech umístěné jednotlivě. Prvek tak nemusí (a někdy ani nemůže) využít pro tvorbu kovalentních vazeb všechny valenční elektrony. Příkladem takových prvků jsou vzácné plyny (třeba He), které mají valenční elektrony v orbitalech výhradně spárované a mohou je jen výjimečně rozdělit. Helium a neon proto téměř netvoří chemické vazby. Některé prvky mohou část nebo všechny valenční elektrony odštěpit a vytvořit [[kationt]]y (zejména reaktivní [[kovy]]), reaktivní [[nekovy]] mohou do valenčních orbitalů naopak elektrony přijmout a vytvořit [[aniont]]y. Tato schopnost souvisí s [[elektronegativita|elektronegativitou]] prvku, při velkém rozdílu elektronegativit mezi vázanými atomy vzniká [[iontová vazba]]. |
Valenční elektrony může atom prvku potenciálně použít pro tvorbu chemické vazby. Hlavní typ chemické vazby – [[kovalentní vazba]] – se vytváří především s využitím nespárovaných valenčních elektronů, tedy těch, které jsou ve valenčních orbitalech umístěné jednotlivě. Prvek tak nemusí (a někdy ani nemůže) využít pro tvorbu kovalentních vazeb všechny valenční elektrony. Příkladem takových prvků jsou vzácné plyny (třeba He), které mají valenční elektrony v orbitalech výhradně spárované a mohou je jen výjimečně rozdělit. Helium a neon proto téměř netvoří chemické vazby. Některé prvky mohou část nebo všechny valenční elektrony odštěpit a vytvořit [[kationt]]y (zejména reaktivní [[kovy]]), reaktivní [[nekovy]] mohou do valenčních orbitalů naopak elektrony přijmout a vytvořit [[aniont]]y. Tato schopnost souvisí s [[elektronegativita|elektronegativitou]] prvku, při velkém rozdílu elektronegativit mezi vázanými atomy vzniká [[iontová vazba]]. |
||
Verze z 11. 11. 2020, 17:20
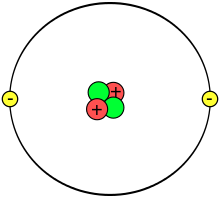
Valenční elektron je elektron v elektronovém obalu umístěný v energeticky nejvýše položené (valenční) vrstvě (příp. několika vrstvách). Jde tedy o elektrony z posledních, největších, orbitalů v rámci elektronové konfigurace atomu. Orbitaly obsahující valenční elektrony se nazývají valenční orbitaly. Tyto elektrony (resp. orbitaly) přijdou nejsnáze do kontaktu s jinými atomy a jejich valenčními elektrony (orbitaly), a díky tomu se mohou podílet na vzniku chemických vazeb mezi atomy. Elektronová konfigurace valenčních elektronů je pak z hlediska chemie nejdůležitější charakteristika atomu konkrétního prvku. Počet elektronů ve valenční slupce je specifický pro daný chemický prvek – podle něj jsou prvky rozděleny do sloupců periodické tabulky – ty se označují jako skupiny. Počet valenčních elektronů většinou určuje maximální oxidační číslo atomu. Skupiny prvků v periodické soustavě byly klasicky číslovány I.A až VIII.A a I.B až VIII.B – zde číslo skupiny odpovídalo počtu valenčních elektronů (s výjimkou části skupiny VIII.B a skupin I.B a II.B). Modernější očíslování skupin 1 až 18 s počtem valenčních elektronů souvisí jen u menší části prvků.

Chemické prvky se dělí na s, p, d a f-prvky podle umístění jejich valenčních elektronů v orbitalech. Prvky s a p se také nazývají nepřechodné prvky, jejich valenční elektrony (nebo orbitaly) jsou pouze v jediné – poslední vrstvě (slupce) obalu atomu – jde o skupiny I.A (1) až VIII.A (17) a počet valenčních elektronů (orbitalů) těchto prvků odpovídá číslu skupiny. Jako přechodné prvky se označují d-prvky. Jejich valenční elektrony (orbitaly) zahrnují poslední a část předposlední vrstvy obalu atomu, jde o skupiny I.B až VIII.B (3 až 10). Zde číslo skupiny odpovídá počtu valenčních elektronů jen u části prvků. Jako vnitřně přechodné se označují f-prvky, které mají valenční elektrony (orbitaly) v posledních třech vrstvách obalu atomu. Obecně je elektronová konfigurace valenčních elektronů s-prvků ns1,2, p-prvků ns2, np1 až 6, d-prvků ns2, (n–1)d1 až 10, kde n je číslo poslední vrstvy obalu atomu (číslo periody, v níž je prvek v periodické soustavě prvků, nejvyšší hodnota kvantového čísla orbitalů daného atomu). Rozdělení prvků za pomoci typu valenčních orbitalů je možné konkretizovat až na označení jednotlivých skupin (sloupců) prvků periodické soustavy. Jsou tak známy s1 a s2 prvky, p1 až p6 prvky, d1 až d10 prvky a f1 až f14 prvky.
Valenční elektrony může atom prvku potenciálně použít pro tvorbu chemické vazby. Hlavní typ chemické vazby – kovalentní vazba – se vytváří především s využitím nespárovaných valenčních elektronů, tedy těch, které jsou ve valenčních orbitalech umístěné jednotlivě. Prvek tak nemusí (a někdy ani nemůže) využít pro tvorbu kovalentních vazeb všechny valenční elektrony. Příkladem takových prvků jsou vzácné plyny (třeba He), které mají valenční elektrony v orbitalech výhradně spárované a mohou je jen výjimečně rozdělit. Helium a neon proto téměř netvoří chemické vazby. Některé prvky mohou část nebo všechny valenční elektrony odštěpit a vytvořit kationty (zejména reaktivní kovy), reaktivní nekovy mohou do valenčních orbitalů naopak elektrony přijmout a vytvořit anionty. Tato schopnost souvisí s elektronegativitou prvku, při velkém rozdílu elektronegativit mezi vázanými atomy vzniká iontová vazba.
Související články
 Obrázky, zvuky či videa k tématu Valenční elektron na Wikimedia Commons
Obrázky, zvuky či videa k tématu Valenční elektron na Wikimedia Commons - Elektron
- Atom
- Elektronegativita
