Kovalentní vazba: Porovnání verzí
→Řád vazby: napřímení odkazu, překlep |
→Vaznost: nová sekce |
||
| Řádek 25: | Řádek 25: | ||
* Šesterná vazba je tvořena sdílením šesti elektronových párů. Tento typ vazby mohou vytvářet pouze přechodné kovy, protože se na ní podílí vyšší orbitaly než d-. Teoreticky byla předpovězena pro molekulu [[Uran (prvek)|U]]<sub>2</sub>, ta však neexistuje. Zaznamenána ale byla u wolframu, v dvouatomové molekule W<sub>2</sub>.<ref name="OSEL" /> |
* Šesterná vazba je tvořena sdílením šesti elektronových párů. Tento typ vazby mohou vytvářet pouze přechodné kovy, protože se na ní podílí vyšší orbitaly než d-. Teoreticky byla předpovězena pro molekulu [[Uran (prvek)|U]]<sub>2</sub>, ta však neexistuje. Zaznamenána ale byla u wolframu, v dvouatomové molekule W<sub>2</sub>.<ref name="OSEL" /> |
||
* Vyšší vazby než šesterné by neměly existovat. Elektronové konfigurace schopné takových vazeb se u známých prvků periodické soustavy nevyskytují.<ref name="OSEL" /> |
* Vyšší vazby než šesterné by neměly existovat. Elektronové konfigurace schopné takových vazeb se u známých prvků periodické soustavy nevyskytují.<ref name="OSEL" /> |
||
== Vaznost == |
|||
Počet kovalentních vazeb (dvojnou vazbu počítáme jako 2 vazby, atd.), které daný prvek tvoří (ať už obecně, či v konkrétním daném případě, pokud je variabilní), nazýváme '''vaznost'''. Např. [[vodík]] je jednovazný, [[kyslík]] je dvojvazný a [[uhlík]] čtyřvazný. |
|||
== Reference == |
== Reference == |
||
Verze z 25. 6. 2018, 15:14
Kovalentní vazba (homopolární) je vnitromolekulární forma chemické vazby, kterou lze charakterizovat sdílením jednoho nebo více párů elektronů mezi dvěma prvky. Atomy, účastnící se vazby, si tímto způsobem zaplňují valenční vrstvu elektronového obalu. Energie kovalentní vazby je větší, než energie intermolekulárních vodíkových vazeb. Tento druh vazby je typický pro atomy organických molekul a pro anorganické látky s krystalickou mřížkou složenou ze stejných atomů (diamant, křemík, germanium, karbid křemíku).
Polarita vazby

Na základě rozdílu elektronegativit prvků tvořících vazbu rozlišujeme polární a nepolární kovalentní vazbu. Polární vazba je tvořena prvky, jejichž rozdíl elektronegativit je větší než 0,4 a menší 1,67. U nepolární vazby musí být hodnota tohoto rozdílu menší než 0,4. Vazby s rozdílem elektronegativit větším než 1,67 nazýváme iontové.
Rozdělení vazeb
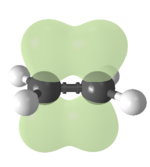
- vazba sigma — místo maximálního překryvu orbitalů leží na spojnici jader vazebných atomů
- vazba pí — místo maximálního překryvu orbitalů leží mimo spojnici jader, orbitaly se překrývají ve dvou místech — např. p-p, p-d, d-d,
Pokud je mezi atomy dvojná nebo trojná vazba, je vždy jedna vazba σ a ostatní jsou vazby π
Řád vazby
Řád vazby charakterizuje počet elektronových párů sdílených mezi atomy (nemusí být nutně celočíselný). Je roven rozdílu počtu vazebných a protivazebných elektronů, dělený dvěma.
- Jednoduchá vazba je tvořena sdílením jednoho elektronového páru (řád vazby je roven jedné). Jako příklad lze uvést vazbu mezi atomy vodíku a kyslíkem v molekule vody.
- Dvojná vazba je tvořena sdílením dvou elektronových párů (např. v molekule ethen; tvoří ji jedna sigma a jedna pi vazba).
- Trojná vazba je tvořena sdílením tří elektronových párů (např. v molekule ethynu; tvoří ji dvě pi a jedna sigma vazba).
- Čtverná vazba je tvořena sdílením čtyř elektronových párů. Tento typ vazby mohou vytvářet pouze přechodné kovy, protože se na ní podílejí d-orbitaly. Je poměrně vzácná, popsána byla např. ve sloučeninách molybdenu a ruthenia.
- Paterná vazba je tvořena sdílením pěti elektronových párů. Tento typ vazby mohou vytvářet pouze přechodné kovy, protože se na ní mohou podílet i vyšší orbitaly než d-. Byla zaznamenána ve sloučenině [CrC6H3-2,6-(C6H4-2,6-(CHMe2)2)2]2, paterná vazba je mezi chromy.[1]
- Šesterná vazba je tvořena sdílením šesti elektronových párů. Tento typ vazby mohou vytvářet pouze přechodné kovy, protože se na ní podílí vyšší orbitaly než d-. Teoreticky byla předpovězena pro molekulu U2, ta však neexistuje. Zaznamenána ale byla u wolframu, v dvouatomové molekule W2.[1]
- Vyšší vazby než šesterné by neměly existovat. Elektronové konfigurace schopné takových vazeb se u známých prvků periodické soustavy nevyskytují.[1]
Vaznost
Počet kovalentních vazeb (dvojnou vazbu počítáme jako 2 vazby, atd.), které daný prvek tvoří (ať už obecně, či v konkrétním daném případě, pokud je variabilní), nazýváme vaznost. Např. vodík je jednovazný, kyslík je dvojvazný a uhlík čtyřvazný.

