Axonový transport
Axonový transport, řidč. axoplazmický tok a axonální transport, je buněčný proces zodpovědný za pohyb mitochondrií, lipidů, synaptických vezikul, proteinů a ostatních buněčných částí (organel) z/do buněčného těla neuronu, prostřednictvím cytoplazmy jeho axonu (axoplazma).[1] Protože některé axony jsou dlouhé v řádu metrů, neurony nemohou spoléhat na prostou difúzi produktů z jádra a organel do konce jejich axonů. Axonový transport je také zodpovědný za pohyb molekul určených k degradaci z axonu zpět do těla buňky, kde jsou zpracovány lysosomy.[2]
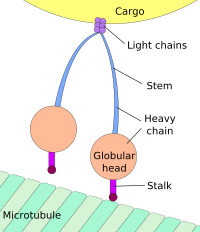
Pohyb směrem k soma (buněčnému tělu) se nazývá retrográdní (zpětný) transport a pohyb směrem k synapsi transport anterográdní (dopředný).[3][4]
Mechanismus
[editovat | editovat zdroj]Drtivá většina axonových proteinů jsou syntetizovány v neuronálních buněčných tělech a jsou přepravovány podél axonů. Některé mRNA translace probíhají v axonech.[5][6] K axonovému transportu dochází v průběhu života neuronu a je nezbytný pro jeho růst a přežití. Mikrotubuly (z tubulinu) běží po celé délce axonu a poskytují cytoskeletální stopu pro přepravu. Rychle rostoucí plus-konec je orientován směrem k synapsím a stabilnější minus-konec směrem k tělu Kinesin a dynein jsou motorové proteiny, které se pohybují náklad v anterográdní (dopředu od soma do axonálního výběžku) a retrográdní (zpět do somy). Motorové proteiny vážou a transportují několik různých nákladů včetně mitochondrií, cytoskeletálních polymerů, autofagosomů, a synaptických vezikul obsahující neurotransmitery.
Axonový transport může být rychlý nebo pomalý a anterográdní nebo retrográdní.
Rychlý a pomalý transport
[editovat | editovat zdroj]Vezikulární náklad se pohybuje relativně rychle (50–400 mm/den) vzhledem k tomu, že doprava rozpustných (cytosolových) a cytoskeletárních proteinů trvá mnohem déle ( méně než 8 mm/den). Základní mechanismus rychlého axonového transportu byl znám dávno, ale mechanismus pomalého axonového transportu byl pochopen až v důsledku pokročilé zobrazovací techniky. Fluorescenční označovací techniky (např. fluorescenční mikroskopie) umožnily přímé vizualizace dopravy v živých neuronech. (Viz také: Anterográdní tracing.)
Nedávné studie odhalily, že pohyb cytoskeletálních „pomalých“ nákladů je skutečnosti rychlý, ale na rozdíl od rychlého náklad často „odpočívá“, takže celková tranzitní doba je mnohem delší. Tento mechanismus je známý jako „Stop and Go“ modelu pomalého axonového transportu a byl ověřen na přepravě neurofilament z cytoskeletálních proteinů.[7] Pohyb rozpustných (cytosolových) nákladů je složitější, ale asi má podobný základ, při kterém se rozpustné proteiny organizovat do multi-proteinových komplexů, které jsou pak dopravovány přechodnými interakcemi rychle.[8][9][10]
Anterográdní transport
[editovat | editovat zdroj]Anterográdní (také „orthográdní“) transport je pohyb molekul/organel ven, od těla buňky (také nazývané soma) do synapse nebo buněčné membrány.
Na anterográdní pohyb nákladů (v transportních vezikulách) pro rychlé i pomalé komponenty podél mikrotubulové je zprostředkován kinesinem. Několik kinesinů byl prokázáno i u pomalého transportu, i když mechanismus pro generování „pauzy“ v tranzitu je stále neznámý.
Retrográdní transport
[editovat | editovat zdroj]Retrográdní transport vede molekuly a organely od axonálního zakončení směrem k tělu buňky. Retrográdní axonální transport je zprostředkován cytoplazmatickým dyneinem, a je používán například k zaslání chemických zpráv (trofické signály při axonálním poškození a produktů endocytóz do endolyzozomů z axonu zpátky do buňky. In vivo rychlost je přibližně 2 µm/sec,[11][12] rychlý retrográdní transport může pokrýt 10–20 centimetrů za den.
MAP
[editovat | editovat zdroj]Maps (microtubule associated proteins) jsou proteiny stabilizující mikrotubuly, neboť mikrotubuly jsou jinak velmi dynamickou strukturou, a regulují jejich polymerizaci a depolymerizaci. Další skupinou jsou MAP motory.
Následky přerušení
[editovat | editovat zdroj]Kdykoli axonální transport je inhibován nebo přerušen, normální fyziologie se stává patofyziologií, a nahromadění axoplasmy (axonální sferoid) může mít nepříznivý následek. Protože axonální transport může být narušen mnoha způsoby, axonální sferoidy byly zjištěny u mnoha různých tříd nemocí, včetně genetických, traumatických, cévních, infekčních, toxických, degenerativních a specifickém onemocněních bílé hmoty zvané leukoencefalopatie. Několik vzácných neurodegenerativních onemocnění jsou spojeny s genetickými mutacemi v motorových proteinech, kinesinu a dyneinu, a v těchto případech je pravděpodobné, že axonový transport je klíčovým hráčem při zprostředkování patologie.[13] Nefunkční axonový transport je také spojen s neurodegenerativními onemocnění jako je Alzheimerova a Parkinsonova nemoc,[14]v důsledku zjištění , že velké axonální akumulace jsou vždy vidět v postižených neuronech, a že geny hrající roli mají také role v normálním axonálním transportu. Zde je ale velmi málo přímých důkazů pro zapojení axonovém transportu v druhém onemocnění, a možná další mechanismy (např. přímá synaptotoxicita) jsou více relevantní.
Protože axon je závislý na axoplazmickém toku životně důležitých bílkovin a materiálu, zranění jako difúzní axonální poranění, která přeruší dopravu způsobí, že distální axon degeneruje v procesu zvaném Wallerianská degenerace. Léky na rakovinu , které zasahují rakovinné bujení , tím, že změní mikrotubuly (které jsou nezbytné pro buněčné dělení), poškodí nervy, protože mikrotubuly jsou nezbytné pro axonální transport.
Infekce
[editovat | editovat zdroj]Virus vztekliny se do centrálního nervového systému dostává zpětným (retrográdním) axoplazmickým tokem.[15] Tetanový neurotoxin je přijat (internalizován) na nervosvalové ploténce prostřednictvím navázání na nidogenní (entactinové) proteiny a je retrográdně transportován směrem k soma v signalizačních endozomech.[16]
Související články
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Axonal transport na anglické Wikipedii.
- ↑ SABRY, J.; O'CONNOR, T. P.; KIRSCHNER, M. W. Axonal Transport of Tubulin in Ti1 Pioneer Neurons in Situ. Neuron. 1995, s. 1247–1256. DOI 10.1016/0896-6273(95)90271-6. PMID 7541635.
- ↑ OZTAS, E. Neuronal Tracing.. Neuroanatomy. 2003, s. 2–5. Dostupné v archivu pořízeném z originálu dne 2005-10-25.
- ↑ Karp G. 2005.
- ↑ Bear et al., 2006.
- ↑ GIUSTETTO, M; HEGDE, AN; SI, K. Axonal transport of eukaryotic translation elongation factor 1alpha mRNA couples transcription in the nucleus to long-term facilitation at the synapse. Proc. Natl. Acad. Sci. USA. 2003, s. 13680–5. DOI 10.1073/pnas.1835674100. PMID 14578450.
- ↑ Si K, Giustetto ETKIN, A. A neuronal isoform of CPEB regulates local protein synthesis and stabilizes synapse-specific long-term facilitation in aplysia. Cell. Dec 2003, s. 893–904. DOI 10.1016/s0092-8674(03)01021-3. PMID 14697206.
- ↑ Brown 2003.
- ↑ Scott et al., 2011.
- ↑ Roy S et al., 2007.
- ↑ KUZNETSOV, Andrey V. Analytical solution of equations describing slow axonal transport based on the stop-and-go hypothesis. Central European Journal of Physics. 2011, s. 662–673. DOI 10.2478/s11534-010-0066-0.
- ↑ GIBBS, Katherine L.; KALMAR, Bernadett; SLEIGH, James N.; GREENSMITH, Linda; SCHIAVO, Giampietro. In vivo imaging of axonal transport in murine motor and sensory neurons. Journal of Neuroscience Methods. 2016-01-15, s. 26–33. Dostupné online. DOI 10.1016/j.jneumeth.2015.09.018. PMID 26424507.
- ↑ SLEIGH, James; SCHIAVO, Giampietro. Older but not slower: aging does not alter axonal transport dynamics of signalling endosomes in vivo . Matters. 2016-06-06. Dostupné online. ISSN 2297-8240. DOI 10.19185/matters.201605000018.
- ↑ MADAY, Sandra; TWELVETREES, Alison E.; MOUGHAMIAN, Armen J.; HOLZBAUR, Erika L.F. Axonal Transport: Cargo-Specific Mechanisms of Motility and Regulation. Neuron. S. 292–309. Dostupné v archivu pořízeném z originálu dne 2018-06-05. DOI 10.1016/j.neuron.2014.10.019. PMID 25374356.
- ↑ ROY, S. Axonal transport defects: a common theme in neurodegenerative. Acta Neuropathol. 2005, s. 5–13. DOI 10.1007/s00401-004-0952-x. PMID 15645263.
- ↑ MITRABHAKDI, E; SHUANGSHOTI, S; WANNAKRAIROT, P; LEWIS, RA; SUSUKI, K. Differences in neuropathogenetic mechanisms in human furious and paralytic rabies. J Neurol Sci. 2005, s. 3–10. DOI 10.1016/j.jns.2005.05.004. PMID 16226769.
- ↑ BERCSENYI, Kinga; SCHMIEG, Nathalie; BRYSON, J. Barney; WALLACE, Martin; CACCIN, Paola; GOLDING, Matthew; ZANOTTI, Giuseppe. Nidogens are therapeutic targets for the prevention of tetanus. Science. 2014-11-28, s. 1118–1123. Dostupné v archivu pořízeném z originálu dne 2016-12-22. ISSN 0036-8075. DOI 10.1126/science.1258138. PMID 25430769. (anglicky)
