Triethylboritan
| Triethylboritan | |
|---|---|
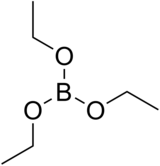 Vzorec | |
| Obecné | |
| Systematický název | Triethylboritan |
| Ostatní názvy | Triethoxid boritý; TEB; Triethylester kyseliny borité |
| Sumární vzorec | C6H15BO3 |
| Vzhled | Bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 150-46-9 |
| Vlastnosti | |
| Molární hmotnost | 149,99 g/mol |
| Teplota tání | −85 °C (188 K) |
| Teplota varu | 118 °C (391 K) |
| Hustota | 0,86 g/cm3 |
| Rozpustnost ve vodě | reaguje za vzniku CH3CH2OH a B(OH)3 |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 |
| P-věty | P210 P233 P260 |
| Teplota vznícení | 11 °C |
Některá data mohou pocházet z datové položky. | |
Triethylboritan (Někdy též triethoxid boritý či nepříliš správně triethylester kyseliny borité), někdy zkráceno na TEB je bezbarvá organická kapalná látka se vzorcem B(OCH2CH3)3.
Výroba
Tato látka se vyrábí reakcí kyseliny borité a ethanolu:
B(OH)3 + 3CH3CH2OH ⇌ B(OCH2CH3)3 + 3H2O
V neutrálním prostředí reakce neprobíhá a udržuje se rovnováha mezi oběma stranami rovnice. S klesajícím pH (v kyselém prostředí) stoupá množství TEB a vody, zatímco v zasaditém prostředí vzniká více kyseliny borité (popř. boritanu) a vody.
Při výrobě se tedy používá okyselení kyselinou sírovou, následně se vzniklé produkty destilují. Na rozdíl od trimethylboritanu triethylboritan má vyšší teplotu varu, než voda, proto se „oddestilovává“ voda a nezreagovaný ethanol, a následně se oddělí novou destilací TEB od kyseliny sírové a nezreagované kyseliny borité.
Reakce

TEB reaguje s vodou za vzniku ethanolu a kyseliny borité, proto musí být chráněn před vzdušnou vlhkostí.
Reaguje také se zásadami, např. hydroxidem sodným, dle rovnice:
B(OCH2CH3)3 + 3NaOH → 3CH3CH2OH + B(ONa)3
Látka je značně hořlavá. Teplota vzplanutí je asi 11 °C, tato látka hoří díky boru zeleným plamenem, ale podstatně méně výrazně než trimethylboritan (v porovnání s tím je plamen TEB namodralý). V případě, že TEB je kontaminován TMB, dojde ke značnému zbarvení do zelena (při výrobě TEB z technického lihu je plamen zelený pro obsah methanolu a následně i TMB). Tohoto efektu se užívá při kvalitativní analýze přítomnosti methanolu v ethanolu.
Hoření probíhá dle rovnice:
4B(OCH2CH3)3 + 39O2 → 4B2O3 + 30H2O + 24CO2
Reference
- ↑ a b Triethyl borate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Triethylboritan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Triethylboritan na Wikimedia Commons



