Izotopy vodíku: Porovnání verzí
nový článek podle enwiki |
pokračování |
||
| Řádek 1: | Řádek 1: | ||
{{Pracuje se}} |
{{Pracuje se|4 dny}} |
||
'''[[Vodík]]''' ('''H''') má tři přírodní izotopy označované <sup>1</sup>H, <sup>2</sup>H a <sup>3</sup>H. První dva jsou stabilní, <sup>3</sup>H má [[poločas přeměny]] 12,32 let. Všechny těžší izotopy byly připraveny uměle a mají poločas kratší než 1 zeptosekunda (10<sup>-21</sup> s). Z nich je nejstabilnější <sup>5</sup>H a nejméně stabilní <sup>7</sup>H.<ref>{{cite journal |
'''[[Vodík]]''' ('''H''') má tři přírodní izotopy označované <sup>1</sup>H, <sup>2</sup>H a <sup>3</sup>H. První dva jsou stabilní, <sup>3</sup>H má [[poločas přeměny]] 12,32 let. Všechny těžší izotopy byly připraveny uměle a mají poločas kratší než 1 zeptosekunda (10<sup>-21</sup> s). Z nich je nejstabilnější <sup>5</sup>H a nejméně stabilní <sup>7</sup>H.<ref>{{cite journal |
||
|author=Y. B. Gurov|coauthors=<!-- --> |
|author=Y. B. Gurov|coauthors=<!-- --> |
||
| Řádek 20: | Řádek 20: | ||
Vodík je jediný prvek, jehož izotopy mají „triviální“ názvy, které jsou stále běžně používány. <sup>2</sup>H je často nazýván '''[[deuterium]]''' nebo ''těžký vodík'' a <sup>3</sup>H má pojmenování '''[[tritium]]''' nebo ''velmi těžký vodík''. Nejjednodušší izotop vodíku, který nemá v [[atomové jádro|jádru]] [[neutron]]y, se nazývá '''[[protium]]'''. |
Vodík je jediný prvek, jehož izotopy mají „triviální“ názvy, které jsou stále běžně používány. <sup>2</sup>H je často nazýván '''[[deuterium]]''' nebo ''těžký vodík'' a <sup>3</sup>H má pojmenování '''[[tritium]]''' nebo ''velmi těžký vodík''. Nejjednodušší izotop vodíku, který nemá v [[atomové jádro|jádru]] [[neutron]]y, se nazývá '''[[protium]]'''. |
||
== Vodík-1 (protium) == |
|||
'''<sup>1</sup>H''' (hmotnost atomu 1,007 825 04(7) [[atomová hmotnostní konstanta|u]]) je nejběžnější izotop vodíku, zaujímá více než 99,98 % vodíkových atomů v přírodě. Protože se jeho jádro skládá pouze z [[proton]]u, nazývá se také ''protium''. |
|||
Rozpad protonu nebyl nikdy pozorován a vodík-1 je tedy považován za stabilní nuklid. Podle některých [[teorie velkého sjednocení|teorií velkého sjednocení]] navržených v [[1970–1979|70. letech 20 století]] by se měl rozpadat s poločasem 10<sup>31</sup> až 10<sup>36</sup> let. Pokud je tato předpověď pravdivá, pak by byl vodík-1 (a všechna další atomová jádra) pouze ''pozorovatelně stabilní''. |
|||
== Vodík-2 (deuterium) == |
|||
{{Viz též|deuterium}} |
|||
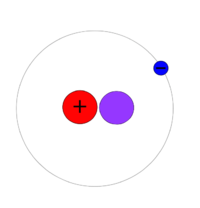
[[Soubor:H-2 atom.png|200px|Model atomu deuteria]] |
|||
'''<sup>2</sup>H''' (hmotnost atomu 2,013 553 212 724(78) [[atomová hmotnostní konstanta|u]]), další stabilní izotop, je známý jako ''deuterium'' a v jádru má jeden proton a jeden neutron. Jádro deuteria se nazývá deuteron. Deuterium zaujímá 0,002 6 až 0,018 4 procent přírodního vodíku (podle počtu atomů), největší výskyt bývá obvykle v mořské vodě. Toto zastoupení je větší, než je ve vesmíru obvyklé (kolem 27 [[ppm]]). Jeho vyšší koncentrace ve vnitřní sluneční soustavě je způsobena nižší [[těkavost]]í <sup>2</sup>H a jeho sloučenin oproti <sup>1</sup>H; kvůli vyšší [[molární hmotnost]]i se totiž pomaleji vypařovaly působením slunečního záření. |
|||
Pro tento izotop se někdy používá [[symbol prvku|chemická značka]] D. |
|||
Deuterium není [[radioaktivita|radioaktivní]] ani [[toxicita|toxické]]. Voda obohacená o molekuly s deuteriem místo protia se nazývá [[těžká voda]] (D<sub>2</sub>O). Existuje rovněž ''polotěžká voda'' (HDO), jejíž molekula má deuteriem nahrazený jen jeden atom protia. Sloučeniny deuteria se používají jako rozpouštědla v [[NMR spektroskopie|NMR spektroskopii]]. Těžká voda slouží jako [[moderátor neutronů]] a chladivo [[jaderný reaktor|jaderných reaktorů]]. Deuterium je také možným zdrojem energie v komerční [[jaderná fúze|jaderné fúzi]]. |
|||
== Vodík-3 (tritium) == |
|||
{{Viz též|tritium}} |
|||
Verze z 24. 2. 2017, 19:37
Vodík (H) má tři přírodní izotopy označované 1H, 2H a 3H. První dva jsou stabilní, 3H má poločas přeměny 12,32 let. Všechny těžší izotopy byly připraveny uměle a mají poločas kratší než 1 zeptosekunda (10-21 s). Z nich je nejstabilnější 5H a nejméně stabilní 7H.[1][2]
Vodík je jediný prvek, jehož izotopy mají „triviální“ názvy, které jsou stále běžně používány. 2H je často nazýván deuterium nebo těžký vodík a 3H má pojmenování tritium nebo velmi těžký vodík. Nejjednodušší izotop vodíku, který nemá v jádru neutrony, se nazývá protium.
Vodík-1 (protium)
1H (hmotnost atomu 1,007 825 04(7) u) je nejběžnější izotop vodíku, zaujímá více než 99,98 % vodíkových atomů v přírodě. Protože se jeho jádro skládá pouze z protonu, nazývá se také protium.
Rozpad protonu nebyl nikdy pozorován a vodík-1 je tedy považován za stabilní nuklid. Podle některých teorií velkého sjednocení navržených v 70. letech 20 století by se měl rozpadat s poločasem 1031 až 1036 let. Pokud je tato předpověď pravdivá, pak by byl vodík-1 (a všechna další atomová jádra) pouze pozorovatelně stabilní.
Vodík-2 (deuterium)
2H (hmotnost atomu 2,013 553 212 724(78) u), další stabilní izotop, je známý jako deuterium a v jádru má jeden proton a jeden neutron. Jádro deuteria se nazývá deuteron. Deuterium zaujímá 0,002 6 až 0,018 4 procent přírodního vodíku (podle počtu atomů), největší výskyt bývá obvykle v mořské vodě. Toto zastoupení je větší, než je ve vesmíru obvyklé (kolem 27 ppm). Jeho vyšší koncentrace ve vnitřní sluneční soustavě je způsobena nižší těkavostí 2H a jeho sloučenin oproti 1H; kvůli vyšší molární hmotnosti se totiž pomaleji vypařovaly působením slunečního záření.
Pro tento izotop se někdy používá chemická značka D.
Deuterium není radioaktivní ani toxické. Voda obohacená o molekuly s deuteriem místo protia se nazývá těžká voda (D2O). Existuje rovněž polotěžká voda (HDO), jejíž molekula má deuteriem nahrazený jen jeden atom protia. Sloučeniny deuteria se používají jako rozpouštědla v NMR spektroskopii. Těžká voda slouží jako moderátor neutronů a chladivo jaderných reaktorů. Deuterium je také možným zdrojem energie v komerční jaderné fúzi.
Vodík-3 (tritium)
- ↑ Y. B. Gurov. Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei. Physics of Atomic Nuclei. 2004, s. 491–497. DOI 10.1134/1.1891200. Bibcode 2005PAN....68..491G.
- ↑ A. A. Korsheninnikov. Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He. Physical Review Letters. 2003, s. 082501. DOI 10.1103/PhysRevLett.90.082501. Bibcode 2003PhRvL..90h2501K.