Lipidový raft

A Intracelulární prostor (cytosol)
B Extracelulární prostor nebo lumen vesiklů/Golgi aparátu
1. Běžná lipidová dvojvrstva (neraftová membrána)
2. Lipidový membránový raft
3. Transmembránový protein asociovaný s lipidovým raftem
4. Neraftový membránový protein
5. Glykosylační modifikace (na glykoproteinech a glykolipidech)
6. GPI-zakotvený protein
7. Cholesterol
8. Glykolipid
V cytoplazmatické membráně buněk se nacházejí glykolipoproteinové mikrodomény, tvořené kombinací glykosfingolipidů a proteinových receptorů, které se nazývají lipidové rafty.[1][2][3] Tyto specializované membránové mikrodomény kompartmentalizují buněčné procesy tím, že slouží jako organizační centra pro uspořádávání signálních molekul, ovlivňují membránovou fluiditu a transport membránových proteinů a regulují neurotransmisi.[3][4] Lipidové rafty jsou více uspořádané než okolní membránová dvojvrstva, ale volně v ní plavou.[5]
Vlastnosti lipidových raftů[editovat | editovat zdroj]
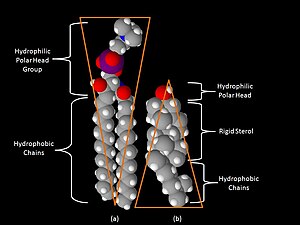
Jedním z klíčových rozdílů mezi lipidovými rafty a plazmatickou membránou, z které jsou rafty odvozeny, je jejich lipidové složení. Lipidové rafty obvykle obsahují 3 až 5násobné množství cholesterolu než okolní dvojvrstva. Jsou také obohaceny o sfingolipidy, jako je například sfingomyelin, kterého je zde typicky o 50 % více než v plazmatické membráně. Aby byl vykompenzován zvýšený obsah sfingolipidů, mají lipidové rafty snížený obsah fosfatidylcholinu, což vede k přítomnosti podobného množství lipidů obsahujících cholin v raftech a v okolní plazmatické membráně. Se sfingolipidy přednostně interaguje cholesterol, a to díky jejich struktuře a nasycenosti uhlovodíkových řetězců. Ačkoli ne všechny fosfolipidy v raftech jsou zcela nasycené, hydrofobní řetězce lipidů obsažených v raftech jsou více nasycené a pevněji uspořádané než lipidy v okolní dvojvrstvě.[4] Cholesterol v raftech funguje jako dynamické "lepidlo", a drží je tak pohromadě.[3] V lipidových raftech se cholesterol převážně nachází díky rigidnímu charakteru jeho sterolové skupiny, která zapadá mezi rovné nasycené acylové řetězce lipidů.[4] Důležitou vlastností membránových lipidů je jejich amfipatický charakter. Amfipatické lipidy mají polární hydrofilní skupinu a nepolární hydrofobní oblast.[6] Obrázek vpravo ukazuje tvar sfingomyelinu (převrácený kužel) a cholesterolu (kužel) a jejich hydrofobní a hydrofilní oblasti. Cholesterol má schopnost vmezeřit se mezi lipidy v raftu, a slouží tak jako molekulární vložka a vyplňuje prázdná místa mezi asociovanými sfingolipidy.[7]
Rietveld a Simons dali lipidové rafty v modelových membránách do spojitosti s nemísitelností uspořádané (Lo fáze) a neuspořádané (Ld nebo Lα fáze) tekuté fáze.[8] Příčina této nemísitelnosti je nejistá, ale má se za to, že nemísitelnost minimalizuje volnou energii mezi oběma fázemi.
Lipidové rafty mohou být při nízkých teplotách (např. 4 °C) z okolní plazmatické membrány extrahovány pomocí neiontových detergentů, jako jsou například Triton X-100 a Brij-98. Je-li takový detergent přidán k buňkám, fluidní plazmatická membrána se rozpustí, zatímco lipidové rafty zůstanou nerozpuštěny a mohou být extrahovány.
Lipidové rafty jsou často kvůli jejich složení a rezistenci vůči detergentům také nazývány GEMs (glycolipid-enriched microdomains) nebo DRM (detergent resistant membranes).[9] Nicméně platnost metodiky pracující s rezistencí raftů vůči detergentům byla zpochybněna, a to kvůli nejasnostem ohledně lipidů a proteinů a pozorování, že jsou schopné vyvolávat vznik pevných struktur tam, kde předtím nebyly.[10]
Historie[editovat | editovat zdroj]
Až do roku 1982 bylo v souladu se Singer-Nicolsonovým modelem tekuté mozaiky, publikovaným v roce 1972, široce přijímáno, že fosfolipidy a membránové proteiny jsou v buněčných membránách náhodně rozmístěny.[4][11] V 70. letech ale Stier & Sackmann a Klausner & Karnovsky s použitím biofyzikálních přístupů postulovali membránové mikrodomény.[12][13] Tyto mikrodomény byly přisouzeny fyzikálním vlastnostem a organizaci lipidových směsí (Stier & Sackmann[12] a Israelachvili et al.[14]). V roce 1974 vedl objev efektů teploty na chování membrány k návrhu "lipidových shluků" v membráně a v roce 1975 data naznačila, že by tyto shluky mohly být kvazikrystalické oblasti obklopené volněji rozptýlenými krystalickými lipidovými molekulami. V roce 1978 vedly rentgenové difrakční studie k dalšímu vývoji tohoto modelu a mikrodomény byly definovány jako "lipidy ve více uspořádaném stavu". V roce 1982 Karnovsky a spolupracovníci formálně stvrdili koncept lipidových domén v membránách. Karnovského výzkum ukázal heterogenitu v délce života 1,6-difenyl-1,3,5-hexatrienu, což indikovalo, že v lipidovém prostředí membrány se nachází několik fází.[4] Jeden typ mikrodomén je tvořen cholesterolem a sfingolipidy. Biltonen, Thompson a jejich spolupracovníci ukázali, že se vytváří díky segregaci těchto lipidů do oddělené fáze.[15] Poté bylo ukázáno, že tyto membrány existují i v buněčných membránách.[16] Později se Kai Simons z Německa a Gerrit van Meer z Nizozemska znovu zaměřili na tyto membránové mikrodomény obohacené o lipidy, cholesterol, glykolipidy a sfingolipidy přítomné v buněčných membránách[17] a následně je pojmenovali jako lipidové rafty. Původní koncept raftů byl využit pro vysvětlení transportu cholesterolu z trans Golgi váčků na plazmatickou membránu, což bylo dále rozvinuto Simonsem a Ikonenovou.[18] V roce 2006 byly na symposiu (Keystone Symposium of Lipid Rafts and Cell Function) lipidové rafty definovány jako "malé (10–200 nm), heterogenní, velmi dynamické, na steroly a sfingolipidy bohaté domény, kompartmentalizující buněčné procesy. Malé rafty mohou být někdy stabilizovány a tvoří větší platformy pomocí protein-proteinových interakcí." V posledních letech se výzkum lipidových raftů snaží odpovědět na klíčové otázky, které vyvolávají kontroverzi v této oblasti a týkají se například velikosti a délky života raftů.[4]
Typy lipidových raftů[editovat | editovat zdroj]
Byly navrženy dva typy lipidových raftů: planární lipidové rafty (také nazývané jako nekaveolární nebo glykolipidové) a kaveoly. Planární rafty jsou definovány tím, že jsou kontinuální s rovinou plazmatické membrány (bez invaginace) a chybí u nich rozpoznávací morfologické znaky. Na druhé straně kaveoly tvoří invaginace plazmatické membrány, tvarem připomínající baňku, obsahují kaveolinové proteiny a jsou to nejsnadněji pozorované struktury v lipidových raftech. Kaveoliny jsou široce exprimovány v cévách v mozku, v endotelových buňkách, astrocytech, oligodendrocytech, Schwannových buňkách, dorsálních kořenových gangliích a neuronech hippocampu. Planární rafty obsahují flotillinové proteiny a nacházejí se v neuronech a leukocytech, kde nejsou přítomny kaveoly. Oba typy raftů mají podobné lipidové složení (jsou obohacené na cholesterol a sfingolipidy). Flotilliny a kaveoliny mají schopnost přivádět do lipidových raftů signální molekuly, a hrají tak důležitou roli například v signální transdukci neurotransmiterů. Tyto mikrodomény prostorově organizují signální molekuly, a tím usnadňují jejich interakce, které jsou nezbytné pro signální transdukci. Mohou ale také signální molekuly oddělovat, brání tedy jejich interakci a inhibují signalizaci.[19]
Lipidové rafty a signální transdukce[editovat | editovat zdroj]
Signální transdukce na buněčné úrovni znamená proces, při kterém buňka převádí jeden druh signálu nebo stimulu na jiný. Přenos signálu nebo stimulu může být jednoduchý, asociovaný s molekulou receptoru. Komplexnější signální transdukce zahrnuje spřažení interakce ligand-receptor s mnoha dalšími intracelulárními ději. Tyto děje zahrnují fosforylace tyrosinovými kinázami a/nebo serin/threoninovými kinázami.[20] Specifita a přesnost přenosu signálu jsou pro buňky nezbytné k tomu, aby mohly efektivně reagovat na změny v prostředí. Toho je částečně dosaženo diferenciální lokalizací proteinů, které se účastní signálních drah. V plazmatické membráně může být této kompartmentalizace dosaženo pomocí lipidových raftů.[21] Jedním ze způsobů, jak můžeme uvažovat o lipidových raftech, je, že po aktivaci receptoru ligandem dochází ke shlukování malých raftů do větších signalizačních platforem.[22] Jestliže se aktivace receptoru odehrává v lipidovém raftu, je signalizační komplex chráněn před neraftovými molekulami, jako mohou být například membránové fosfatázy. Asociace proteinů s rafty tedy přivádí proteiny do nového mikro-prostředí, kde může být jejich fosforylační stav modifikován zde přítomnými kinázami, což může spouštět následnou signalizaci.[23] Lipidové rafty hrají roli v mnoha signálních procesech, jako je signalizace receptoru pro imunoglobulin E, antigenně specifického receptoru T a B lymfocytů, receptoru pro EGF, insulin a tak dále.
Signalizace receptoru pro imunoglobulin E[editovat | editovat zdroj]
U signalizace receptoru pro imunoglobulin E byla poprvé přesvědčivě demonstrována úloha lipidových raftů v signální transdukci.[24][25][26] Důkazy pro tento fakt zahrnovaly: sníženou rozpustnost Fc-epsilon receptorů (FcεR) v Tritonu X-100 po prokřížení receptorů[24], tvorbu shluků vizualizovatelných fluorescenční mikroskopií (detekce gangliosidů a GPI-kotvených proteinů)[27][28] a inhibici signalizace IgE po depleci cholesterolu pomocí methyl-beta-cyklodextrinu.[29] Signalizace z receptoru pro IgE probíhá takto: IgE se váže na Fc-epsilon receptory (FcεR), které jsou svými Fc segmenty kotveny v plazmatické membráně žírných buněk a bazofilů. FcεR je tetramer, který se skládá z jednoho α, jednoho β a dvou γ řetězců.[26] Jedna molekula FcεR váže jednu molekulu IgE. α řetězec váže IgE, zatímco zbývající obsahují ITAM motivy (immune receptor tyrosine-based activation motifs). Naváže-li se potom oligomerní antigen na IgE molekuly navázané na svých receptorech, dochází k prokřížení jednoho nebo více těchto receptorů. Toto prokřížení vede k interakci s acylovanou nereceptorovou kinázou Lyn z rodiny Src, která fosforyluje receptorové ITAMy. Na tyto fosforylované ITAMy se pak váže kináza z rodiny Syk a iniciuje signální kaskádu.[24][25] Syk může poté aktivovat další proteiny, například adaptorové z rodiny SLP-76, které přichází do raftu a amplifikují signál.[30]
T buněčná signalizace[editovat | editovat zdroj]
T buněčný antigenně specifický receptor (TCR) je molekula nacházející se na povrchu T lymfocytů (T buněk). Skládá se z αβ-heterodimerů, CD3 (γδε) komplexu a ξ-homodimeru. Extracelulární části α- a β-podjednotek obsahují vazebná místa pro antigenní peptid prezentovaný na MHC molekulách na povrchu antigen prezentujících buněk. CD3 a ξ-podjednotky obsahují ve své intracelulární části ITAM motivy. MHC molekuly přivádí během signalizace dvě nebo více receptorů TCR k sobě. Toto prokřížení pak vede, podobně jako u IgE signalizace, k fosforylaci ITAMů kinázami z rodiny Src.[31][32] Na fosforylované ITAMy se pak váže kináza ZAP-70 (podobně jako u signalizace IgE z rodiny Syk, ale jiný zástupce), což vede k její aktivaci, aktivaci adaptorové molekuly LAT a následné amplifikaci signálu. Dalším rozdílem mezi signalizací IgE a TCR je, že aktivace Lck po stimulaci TCR může vést k výraznějšímu klastrování raftů, a tedy k větší amplifikaci signálu.[33][34] Jednou z možností negativní regulace signalizace TCR je vazba cytosolické kinázy Csk na protein asociovaný s rafty CBP. Csk pak může prostřednictvím inhibiční fosforylace inhibovat kinázy z rodiny Src.[35]
B buněčná signalizace[editovat | editovat zdroj]
B buněčný antigenně specifický receptor (BCR) je tvořen membránově vázanou molekulou imunoglobulinu (mIg) a heterodimerem Igα/Igβ. Igα a Igβ obsahují ITAM motivy. Proces signalizace BCR je podobný jako u IgE a TCR. Lipidové rafty hrají ale také úlohu v mnoha dalších událostech podílejících se na aktivaci buněk B. Kromě signalizace BCR sem patří modulování signalizace koreceptory, signalizace CD40, endocytóza antigenu vázaného na BCR a jeho transport do pozdních endosomů, transport komplexů peptid-MHCII na povrch buňky a účast na prezentaci antigenu T buňce.[36]
Lipidové rafty a endocytóza[editovat | editovat zdroj]
Lipidové rafty se také uplatňují v ději zvaném raft-dependentní endocytóza, a to kaveolární nebo nekaveolární (obojí nezávislé na klatrinu).
Pro vznik kaveolárních endocytických váčků je důležitá schopnost proteinu kaveolinu vytvářet oligomery (14–16 molekul) pomocí jeho oligomerizační domény. To vede v plazmatické membráně ke vzniku mikrodomén bohatých na kaveolin. Zvýšení obsahu cholesterolu a vložení „scaffolding“ domény kaveolinu do membrány zde pak vede k expanzi kaveolární invaginace a vzniku endocytického váčku. Váček je od plazmatické membrány odštěpen pomocí proteinu dynamin II, který je lokalizován na krčku vznikajícího váčku. Tento druh endocytózy se uplatňuje například při transcytóze albuminu v endoteliálních buňkách nebo internalizaci insulinového receptoru v primárních adipocytech.[37]
Nekaveolární raft-dependentní endocytóza může být závislá nebo nezávislá na dynaminu. Na dynaminu závislou a klatrinu nezávislou endocytózou jsou například v lymfocytech konstitutivně internalizovány receptory pro interleukin-2, lokalizované v lipidových raftech. Naopak na dynaminu nezávislá endocytóza se podílí například na pinocytóze nebo na internalizaci CT-B v myších embryonálních fibroblastech.[37]
Lipidové rafty a apoptóza[editovat | editovat zdroj]
Lipidové rafty také vytvářejí signalizační platformy pro spouštění jak proapoptotických, tak protiapoptotických drah. Lipidové rafty mohou ovlivňovat důležité apoptotické signalizační události, jako je aktivace apoptotických receptorů, aktivace nebo deaktivace proteinových kináz a změna intracelulární koncentrace vápníku. Toho využívá řada protinádorových léčiv, která jsou schopná narušit integritu lipidových raftů, a tím spustit apoptózu u nádorových buněk.[38]
Lipidové rafty a buněčná adheze[editovat | editovat zdroj]
Lipidové rafty se také uplatňují v buněčné adhezi a migraci, což jsou děje nezbytné například pro invazi nádorových buněk. Bylo ukázáno, že změna koncentrace cholesterolu mění regulovanou membránovou lokalizaci molekuly CD44, která je nezbytná pro zvýšení adhezivity a migrace nádorových buněk. Organizace lipidových raftů také ovlivňuje funkci integrinů, které jsou důležité pro mezibuněčný kontakt a kontakt s extracelulární matrix. Lipidové rafty jsou také potřeba pro vznik invadopodií, například u buněk rakoviny prsu. Invadopodia jsou výběžky invazivních nádorových buněk, které zajišťují degradaci extracelulární matrix, a usnadňují tak buňkám migraci.[39]
Vizualizace lipidových raftů[editovat | editovat zdroj]
Jeden z hlavních důvodů ke kontroverzi okolo lipidových raftů pramení z námitek ohledně studia raftů v živých buňkách, které se nenachází v termodynamické rovnováze.[19] Lipidové rafty jsou malé mikrodomény o velikosti pohybující se mezi 10 a 200 nm[4], tedy pod rozlišovací schopností světelného mikroskopu, a je tak obtížné vizualizovat je přímo. V současné době jsou studovány syntetické membrány, jejichž používání má ale několik nevýhod. Za prvé, ve srovnání s biomembránami mají syntetické membrány nižší koncentraci proteinů. Také je obtížné modelovat interakce membrány s cytoskeletem, které jsou u biomembrán přítomny. Mezi další úskalí patří nepřítomnost přirozené asymetrie a nemožnost studovat membrány v nerovnovážných podmínkách.[4][40] Navzdory těmto nedostatkům je fluorescenční mikroskopie pro studium lipidových raftů často používaná. Například jsou využívány fluorofory konjugované s B-podjednotkou choleratoxinu (CT-B), která se váže na složku raftů, gangliosid GM1. Používají se také lipofilní membránové barvy, které se buď dělí mezi lipidové rafty a okolní membránu, nebo mění své fluorescenční vlastnosti podle fáze membrány. Příkladem takové barvy je Laurdan. Rafty mohou být také značeny za pomoci exprese fluorescenčních fúzních proteinů, například Lck-GFP.
Jednou z nejpoužívanějších metod pro studium lipidových raftů je manipulace s cholesterolem. Možnostmi jsou sekvestrace (pomocí filipinu, nystatinu nebo amfotericinu), deplece a odstranění (pomocí methyl-beta-cyklodextrinu) nebo inhibice syntézy cholesterolu (pomocí inhibitorů HMG-CoA reduktázy). Tyto přístupy například umožňují pozorovat účinky snížení hladiny cholesterolu na signalizaci neurotransmiteru.[19]
Sharma a kolegové použili vysokorozlišovací mikroskopii v kombinaci s matematickým modelováním a ukázali, že se raftové proteiny shlukují do nanoklastrů s poloměrem 5–20 nm. Dále pak pomocí FRET (fluorescence resonance energy transfer) mikroskopie ukázali, že frakce (20–40 %) GPI-kotvených proteinů se shlukuje do klastrů o poloměru 4–5 nm a že každý tento klastr se skládá z několika mála různých GPI-kotvených proteinů.[41] Aby se zamezilo problémům s malou velikostí a dynamickou strukturou, používají se také chlazené citlivé CCD kamery, sledující pouze jednu částici, a TIRF (total internal reflection fluorescence) mikroskopie. To umožňuje zjistit míru difúze částic a ohraničení jejich pohybu.[42]
Jsou také používány další optické techniky: pomocí FCS / FCC spektroskopie (fluorescence correlation a cross-correlation spectroscopy) můžeme získat informace o mobilitě fluoroforu v membráně, FRET mikroskopie může detekovat úzkou blízkost fluoroforů a pomocí optické pinzety můžeme studovat viskozitu membrány.[19]
Dalšími metodami jsou AFM (atomic force microscopy) mikroskopie, SICM (scanning ion conductance microscopy) mikroskopie, duální polarizační interferometrie, nukleární magnetická rezonance (NMR), i když fluorescenční mikroskopie zůstává dominantní technikou. V budoucnu by mohly být problémy plynoucí z difrakčního limitu překonány superrozlišovací mikroskopií, jako je STED (stimulated emission depletion) mikroskopie, nebo dalšími druhy mikroskopie.[43]
Metody používané pro analýzu lipidových raftů dále zahrnují ELISA, western blotting a FACS.[44][45][46]
Kontroverze okolo lipidových raftů[editovat | editovat zdroj]
Navzdory velkému množství experimentů, využívajících několik metod, není zatím role lipidových raftů v buněčné signalizaci, transportu a struktuře jasná, a dokonce i samotná existence raftů je stále kontroverzním tématem.[47]
Mezi argumenty proti existenci lipidových raftů patří:
- Mezi Lα a Lo fázi by mělo existovat hraniční napětí (line tension). To bylo pozorováno na modelových membránách, ale ne v živých systémech.
- Neexistuje žádný konsensus ohledně velikosti lipidových raftů. Pohybuje se mezi 1 a 1000 nm.
- Není známa doba existence lipidového raftu. I kdyby rafty existovaly, mohly by existovat jen velmi krátkou dobu, která by byla pro biologické procesy bezvýznamná.
- Celá membrána může existovat v Lo fázi.
Protiargumentem proti poslednímu bodu je, že Lo fáze lipidových raftů je těsněji uspořádaná díky intermolekulárním vodíkovým můstkům mezi sfingolipidy a cholesterolem.[48]
Další spor se týká efektivity rozrušování lipidových raftů během experimentů. Pike a Miller poukazují na potenciální problém při využití deplece cholesterolu pro určení funkce raftu.[49] Říkají, že většina vědců používá pro depleci cholesterolu metodu, která narušuje i strukturu lipidu známého jako PI(4,5)P2. PI(4,5)P2 hraje důležitou roli v regulaci buněčného cytoskeletu, a jeho odstranění může tedy vést ke stejným výsledkům jako deplece cholesterolu, například k laterální difúzi proteinů v membráně. Kwik s kolegy tedy uzavřeli, že ztráta určité buněčné funkce po depleci cholesterolu nemusí být nutně způsobena rozrušením lipidových raftů, protože mohou být ovlivněny i procesy na raftech nezávislé.[50][51] Také se myslí, že lipidové rafty jsou nějakým způsobem spojeny s proteiny. Edidin ale oponuje, že proteiny přitahují raftové lipidy přes své acylové řetězce.[52]
Reference[editovat | editovat zdroj]
- ↑ Thomas S., Pais A.P., Casares S and Brumeanu T.D. (2004). Analysis of lipid rafts in T cells. Molecular Immunology 41: 399–409.
- ↑ Thomas S., Kumar R.S. and Brumeanu.T.D (2004). Role of lipid rafts in T cells. AITE 52: 215–224.
- ↑ a b c Korade, Z.; Kenworthy, A. K. (2008). "Lipid rafts, cholesterol, and the brain". Neuropharmacology 55 (8): 1265.
- ↑ a b c d e f g h Pike, L. J. (2008). "The challenge of lipid rafts". The Journal of Lipid Research 50: S323.
- ↑ Simons, K.; Ehehalt, R. (2002). "Cholesterol, lipid rafts, and disease". Journal of Clinical Investigation 110 (5): 597.
- ↑ Fantini, J.; Garmy, N.; Mahfoud, R.; Yahi, N. (2004). "Lipid rafts: structure, function and role in HIV, Alzheimer's and prion diseases". Expert Reviews in Molecular Medicine 4 (27): 1–22.
- ↑ Fantini J, Garmy N, Mahfoud R, Yahi N (December 2002). "Lipid rafts: structure, function and role in HIV, Alzheimer's and prion diseases". Expert Reviews in Molecular Medicine 4 (27): 1–22.
- ↑ Rietveld A, Simons K (November 1998). "The differential miscibility of lipids as the basis for the formation of functional membrane rafts". Biochim. Biophys. Acta 1376 (3): 467–79.
- ↑ Fivaz M, Abrami L, van der Goot FG (June 1999). "Landing on lipid rafts". Trends Cell Biol. 9 (6): 212–3.
- ↑ Heerklotz H (November 2002). "Triton promotes domain formation in lipid raft mixtures". Biophys. J. 83 (5): 2693–701.
- ↑ Singer SJ, Nicolson GL (February 1972). "The fluid mosaic model of the structure of cell membranes". Science 175 (4023): 720–31.
- ↑ a b Stier A, Sackmann E (July 1973). "Spin labels as enzyme substrates. Heterogeneous lipid distribution in liver microsomal membranes". Biochim. Biophys. Acta 311 (3): 400–8.
- ↑ Karnovsky MJ, Kleinfeld AM, Hoover RL, Klausner RD (July 1982). "The concept of lipid domains in membranes". J. Cell Biol. 94 (1): 1–6.
- ↑ Israelachvili JN, Marcelja S, Horn RG (May 1980). "Physical principles of membrane organization". Q. Rev. Biophys. 13 (2): 121–200.
- ↑ Estep TN, Mountcastle DB, Barenholz Y, Biltonen RL, Thompson TE (May 1979). "Thermal behavior of synthetic sphingomyelin-cholesterol dispersions". Biochemistry 18 (10): 2112–7.
- ↑ Goodsaid-Zalduondo F, Rintoul DA, Carlson JC, Hansel W (July 1982). "Luteolysis-induced changes in phase composition and fluidity of bovine luteal cell membranes". Proc. Natl. Acad. Sci. U.S.A. 79 (14): 4332–6.
- ↑ Simons K, van Meer G (August 1988). "Lipid sorting in epithelial cells". Biochemistry 27 (17): 6197–202.
- ↑ Simons K, Ikonen E (June 1997). "Functional rafts in cell membranes". Nature 387 (6633): 569–72.
- ↑ a b c d Allen, John A. "Lipid raft microdomains and neurotransmitter signalling." Nature 8 (2007): 128–140.
- ↑ King, M. K. "Mechanisms of Signal Transduction". IU school of Medicine. 7 November 2010. Accessed 3 February 2011.
- ↑ Peter W. Janes, Steven C. Ley, Anthony I. Magee and Panagiotis S. Kabouridis (February 2000). "The role of lipid rafts in T cell antigen receptor (TCR) signalling". Seminars in Immunology 12 (1): 23–24.
- ↑ Schmitz G, Grandl M (March 2008). "Update on lipid membrane microdomains". Curr Opin Clin Nutr Metab Care 11 (2): 106–112.
- ↑ Simons Kai1 , Toomre Derek (October 2000). "LIPID RAFTS AND SIGNAL TRANSDUCTION". Nature Reviews Molecular Cell Biology 1 (1): 31–39.
- ↑ a b c Field, Kenneth A.; Holowka, David; Baird, Barbara (September 1995). "Fc epsilon RI-mediated recruitment of p53/56lyn to detergent-resistant membrane domains accompanies cellular signaling". Proc. Natl. Acad. Sci. USA 92 (20): 9201–9205.
- ↑ a b Erin D Sheets, David Holowka and Barbara Baird (February 1999). "Membrane organization in immunoglobulin E receptor signaling". Current Opinion in Chemical Biology 3 (1): 95–99.
- ↑ a b Barbara Baird, , Erin D. Sheets and David Holowka (December 1999). "How does the plasma membrane participate in cellular signaling by receptors for immunoglobulin E?". Biophysical Chemistry 82 (2–3): 109–119.
- ↑ Thomas P. Stauffer, and Tobias Meyer (December 1997). "Compartmentalized IgE Receptor–mediated Signal Transduction in Living Cells". J. Cell Biol. 139 (6): 1447–1454.
- ↑ David Holowka, Erin D. Sheets and Barbara Baird (2000). "Interactions between FceRI and lipid raft components are regulated by the actin cytoskeleton". Journal of Cell Science 113 (6): 1009–1019. PMID 10683149
- ↑ Erin D. Sheets, David Holowka, and Barbara Baird (May 1999). "Critical Role for Cholesterol in Lyn-mediated Tyrosine Phosphorylation of FcεRI and Their Association with Detergent-resistant Membranes". J. Cell Biol. 145 (4): 877–887.
- ↑ Ryo Goitsuka, Hideki Kanazashi, Hiroki Sasanuma, Yu-ichi Fujimura, Yuri Hidaka, Akiko Tatsuno, Chisei Ra, Katsuhiko Hayashi and Daisuke Kitamura (April 2000). "A BASH/SLP-76-related adaptor protein MIST/Clnk involved in IgE receptor-mediated mast cell degranulation". International Immunology 12 (4): 573–580.
- ↑ Peter W. Janes, Steven C. Ley, Anthony I. Magee and Panagiotis S. Kabouridis (February 2000). "The role of lipid rafts in T cell antigen receptor (TCR) signalling". Seminars in Immunology 12 (1): 23–24.
- ↑ Claire Langlet, Anne-Marie Bernard, Philippe Drevot and Hai-Tao He (June 2000). "Membrane rafts and signaling by the multichain immune recognition receptors". Current Opinion in Immunology 12 (3): 250–255.
- ↑ Weiguo Zhang, Ronald P. Trible and Lawrence E. Samelson (August 1998). "LAT Palmitoylation: Its Essential Role in Membrane Microdomain Targeting and Tyrosine Phosphorylation during T Cell Activation". Immunity 9 (2): 239–246.
- ↑ Tomas Brdicka, Jan Cerný, and Vaclav Horejsi (July 1998). "T Cell Receptor Signalling Results in Rapid Tyrosine Phosphorylation of the Linker Protein LAT Present in Detergent-Resistant Membrane Microdomains". Biochemical and Biophysical Research Communications 248 (2): 356–360.
- ↑ Leslie A. Cary1 & Jonathan A. Cooper1 (April 2000). "Signal transduction: Molecular switches in lipid rafts". Nature 404 (6781): 945–947.
- ↑ Neetu Gupta, and Anthony L. DeFranco (October 2007). "Lipid rafts and B cell signaling". Seminars in Cell & Developmental Biology 18 (5): 616–626.
- ↑ a b Lajoie, P. and I.R. Nabi, Lipid rafts, caveolae, and their endocytosis. Int Rev Cell Mol Biol, 2010. 282: p. 135–163.
- ↑ George, K.S. and S. Wu, Lipid raft: A floating island of death or survival. Toxicol Appl Pharmacol, 2012. 259(3): p. 311-9.
- ↑ Murai, T., The role of lipid rafts in cancer cell adhesion and migration. Int J Cell Biol, 2012. 763283: p. 29.
- ↑ Jacobson, Ken. "Lipid rafts: at a crossroad between cell biology and physics." Nature Cell Biology 9 (2007): 7–13.
- ↑ Sharma P, Varma R, Sarasij RC, et al. (February 2004). "Nanoscale organization of multiple GPI-anchored proteins in living cell membranes". Cell 116 (4): 577–589.
- ↑ Ritchie, Ken. "Detection of Non-Brownian Diffusion in the Cell Membrane in Single Molecule Tracking." Biophysical Journal 88 (2005): 2266–2277.
- ↑ Christian Eggeling, Christian Ringemann & Stefan W. Hell, et al. (February 2009). "Direct observation of the nanoscale dynamics of membrane lipids in a living cell". Nature 457 (7233): 1159–1162.
- ↑ Thomas S, Kumar RS, Casares S, Brumeanu TD. (2003). Sensitive detection of GM1 lipid rafts and TCR partitioning in the T cell membrane. J Immunol Methods 275: 161–168.
- ↑ Thomas S, Kumar R, Preda-Pais A, Casares S, Brumeanu TD. (2003). A model for antigen-specific T-cell anergy: displacement of CD4-p56(lck) signalosome from the lipid rafts by a soluble, dimeric peptide-MHC class II chimera. J Immunol.170: 5981–5992.
- ↑ Thomas S., Pais A.P., Casares S and Brumeanu T.D. (2004). Analysis of lipid rafts in T cells. Molecular Immunology 41: 399–409.
- ↑ Munro, S (2003). "Lipid rafts: elusive or illusive?". Cell 115: 377–388. PMID 14622593.
- ↑ Barenholz Y (2004). "Sphingomyelin and cholesterol: from membrane biophysics and rafts to potential medical applications". Subcell. Biochem. 37: 167–215.
- ↑ Pike LJ, Miller JM (August 1998). "Cholesterol depletion delocalizes phosphatidylinositol bisphosphate and inhibits hormone-stimulated phosphatidylinositol turnover". J. Biol. Chem. 273 (35): 22298–304.
- ↑ Caroni P (August 2001). "NEW EMBO MEMBER'S REVIEW: Actin cytoskeleton regulation through modulation of PI(4,5)P2 rafts". EMBO J. 20 (16): 4332–6.
- ↑ Kwik J, Boyle S, Fooksman D, Margolis L, Sheetz MP, Edidin M (November 2003). "Membrane cholesterol, lateral mobility, and the phosphatidylinositol 4,5-bisphosphate-dependent organization of cell actin". Proc. Natl. Acad. Sci. U.S.A. 100 (24): 13964–9.
- ↑ Edidin M (2003). "The state of lipid rafts: from model membranes to cells". Annu Rev Biophys Biomol Struct 32: 257–83.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu lipidový raft na Wikimedia Commons
Obrázky, zvuky či videa k tématu lipidový raft na Wikimedia Commons - (anglicky) Vesmir.cz: Membránové rafty: historie a současnost[nedostupný zdroj]
