Fluoridy dusíku
Vzhled

Fluoridy dusíku jsou sloučeniny dusíku a fluoru. Je známo mnoho různých fluoridů dusíku:
- Fluorid dusný (NF)
- Radikál fluorid dusnatý (NF2)
- Fluorid dusitý (NF3)
- Fluorid dusičný (NF5)
- Difluordiazen (N2F2)
- Tetrafluorhydrazin (N2F4)
- Fluorazid (N3F)
- Tetrafluoramonium (NF4+)
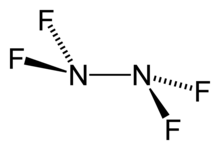

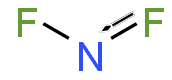
Fyzikální vlastnosti
[editovat | editovat zdroj]| Sloučenina | Teplota tání (°C) | Teplota varu (°C) | Standardní slučovací entalpie (kJ/mol) |
|---|---|---|---|
| Fluorid dusitý | -206,8 | -129 | -131,7 |
| Tetrafluorhydrazin | -161,5 | -74,5 | -22 |
| Difluordiazen (cis izomer) | -195 | -105,7 | 62 |
| Difluordiazen (trans izomer) | -172 | -111,4 | 67,3 |
Chemické vlastnosti
[editovat | editovat zdroj]Fluoridy dusíku jsou tepelně nestabilní, rozkládají se při zahřátí na teploty 100-300 °C:
- 3 N2F4 → 6 NF2 → 4 NF3 + N2
- N2F2 → N2 + F2
Příprava
[editovat | editovat zdroj]- Fluorid dusitý vzniká elektrolýzou taveniny NH4HF2 nebo fluorací amoniaku na měděném katalyzátoru.[1]
- Tetrafluorhydrazin vzniká reakcí fluoridu dusitého s uhlíkem.
- Difluordiazen vzniká reakcí fluoru s azidem sodným.[1][2]
Využití
[editovat | editovat zdroj]Fluoridy dusíku se využívají jako fluorační činidla a oxidační činidla. Využívají se také jako raketová paliva.[2]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byly použity překlady textů z článků Nitrogen fluoride na anglické Wikipedii a Фториды азота na ruské Wikipedii.
- ↑ a b GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 1635 s. s. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. S. 528-533.
- ↑ a b ЗЕФИРОВ, Н. С. Химическая энциклопедия. [s.l.]: Советская энциклопедия 680 s. Dostupné online. ISBN 978-5-85270-008-7. (rusky)
