Coreyova–Itsunova redukce
Coreyova–Itsunova redukce, také nazývaná Coreyova–Bakšiova–Šibatova (CBS) redukce, je chemická reakce, ve které je nechirální keton enantioselekivně redukován na příslušný chirální alkohol. Oxazaborolidinové činidlo řídicí enantioselektivní redukci vyvinul S. Itsuno, přesnější název procesu je tak Itsunova-Coreyova oxazaborolidinová redukce.[1]

V roce 1981 Itsuno popsal využití chirálních alkoxyaminboranových komplexů při redukci nechirálních ketonů na chirální alkoholy, probíhající enantioselektivně a s vysokou výtěžností.[1] Následně roku 1987 E. J. Corey vyvinul reakci chirálních aminoalkoholů s borany (BH3), jejímiž produkty jsou oxazaborolidiny, katalyzující enantioselektivní redukci nechirálních ketonů v přítomnosti BH3•THF.[2][3]
CBS redukce se poté stala běžnou metodou asymetrické redukce nechirálních ketonů. Je součástí přípravy několika přírodních látek a využití má i v průmyslu. Bylo vydáno několik prací zabývajících se touto reakcí.[4][5][6]
Mechanismus[editovat | editovat zdroj]
Corey původně navrhl tento mechanismus vysvětlující selektivitu katalytické redukce:[2][3]
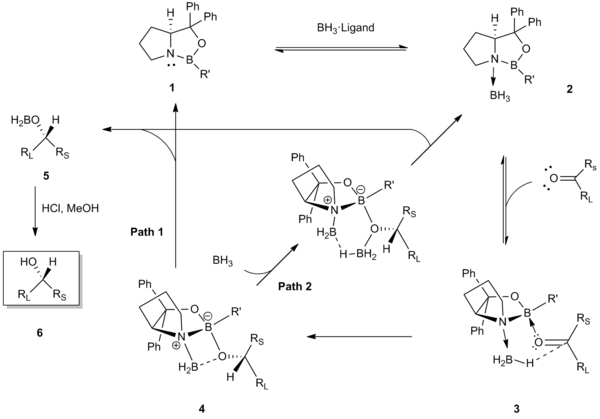
První krok v koordinaci BH3na dusíkový atom oxazaborolidinového katalyzátoru 1. Tato koordinace aktivuje BH3 jako donor hydridu a zvýší Lewisovskou kyselost endocyklického boru v molekule katalyzátoru.[5] Struktura (zjištěná pomocí rentgenové krystalografie a 11B NMR spektroskopie 2 podporují tento průběh.[5][7] Následně se endocyklický bor koordinuje n stericky dostupnější volný elektronový pár ketonu (pár, který je blíže k menšímu substituentu, Rs). Toto přednostní navazování u 3 minimalizuje sterické interakce mezi ketonem a R’ skupinou katalyzátoru a seřadí karbonyl a koordinovaný boran do uspořádání výhodného pro stranově selektivní přenos hydridu přes šestičlenný přechodný stav 4.[8][9] Přenosem hydridu se vytvoří chirální alkoxyboran 5, který se v kyselém prostředí přemění na chirální alkohol 6. Posledním krokem je obnova katalyzátoru, ta může proběhnout dvěma způsoby.[10][11][12]
Hlavní hnací silou pro přenos hydridu je současná aktivace boranu koordinací na Lewisovsky zásaditý dusík a navýšení Lewisovské kyselosti endocyklického atomu boru.[5]
Rozsah a omezení[editovat | editovat zdroj]
Stereoselektivita a chemoselektivita[editovat | editovat zdroj]
CBS redukce je účinným, stereoselektivním i chemoselektivním postupem redukce řady různých druhů ketonů. Jako substráty lze použít mnoho arylalifatických, dialifatických, a diarylových ketonů, α,β-nenasycené enony a ynony, stejně jako ketony obsahující heteroatomy.[5][13]
K vylepšení enantioselektivity CBS redukcí byly použity různé obměny katalyzátorů i boranových redukčních činidel.

U diarylových ketonů 9 byla dosažena poměrně vysoká stereoselektivita i přes isosterové vlastnosti ketonových substituentů, což naznačuje, že stereoselektivitu kromě sterických ovlivňují i elektronové jevy.[5] Rozdíly v substitucích alkynových skupin ynonů 11 a 12 způsobují změny v selektivitě, protože alkyny jsou stericky mohutnějšími substituenty. U α,β nenasycených systémů 10-12 probíhá efektivní redukce ketonů i přesto, že může docházet k vedlejším reakcím v podobě hydroborací nenasycených vazeb C-C. Při CBS redukcích je možná přítomnost heteroatomů v ketonu 13, který se může koordinovat na boran.
Experimentální zjištění a omezení[editovat | editovat zdroj]
Přítomnost vody v reakční směsi výrazně snižuje enantiomerní přebytky a tak je třeba každou CBS redukci provádět v bezvodém prostředí.[14] Významný vliv na stereoselektivitu má i teplota; při nižších teplotách jsou dosahovány určité hodnoty enantiomerního přebytku, které se s rostoucí teplotou zvyšují a dosahují maxima, které je závislé na struktuře katalyzátoru i použitého boranu.[15]
Nízké enantiomerní přebytky za nižších reakčních teplot lze upravit použitím katecholboranu, který při zapojení do CBS redukcí i při -126 °C vede k významné enantioselektivitě.[16][17]
Bylo zjištěno, že BH3 použitý jako redukční činidlo při CBS redukcích zhoršuje enantioselektivitu, komerčně dostupné roztoky BH3•THF často obsahují stopová množství borohydridů, které způsobují neselektivní redukce vedoucí ke snížení enantioselektivity.[18]
I když jsou redukce katalyzované borohydridy mnohem pomalejší než CBS redukce, tak zde probíhá výzkum ohledně možného zlepšení stereoselektivity.
V roce 2012 byl nalezen bezpečný a nepříliš nákladný postup asymetrické redukce ketonů s využitím in situ připraveného N,N-diethylanilin-boranu a oxazaborolidinu získaných reakcí tetrahydridoboritanu sodného, N,N-diethylanilinhydrochloridu a (S)-α,α-difenylprolinolu.[19]
Varianty[editovat | editovat zdroj]
I když je katalyzátor CBS 1 vyvinutý Coireyem při CBS redukcích používán často, tak byly vytvořeno a úspěšné použito i několik jeho derivátů. R’ skupina katalyzátoru významně ovlivňuje enantioselektivitu redukce a k optimalizaci selektivity bylo vyvinuto několik jejích variant.[5][13]
Využití[editovat | editovat zdroj]
CBS redukce mají význam díky využití při přípravě řady přírodních látek, jako jsou laktony, terpenoidy, alkaloidy, steroidy a biotiny.[5][6][20]
Enantioselektivní redukční reakce se také využívají v průmyslu. CBS redukce je mimo jiné součástí totální syntézy MK-0417, ve vodě rozpustného inhibitoru anhydrázy používaného ke snižování nitroočního tlaku.[14] Jde o asymetrickou redukci bicyklického sulfonu za přítomnosti oxazaborolidinového katalyzátoru, kde je R’ skupinou methyl.

Asymetrická redukce 1,1,1-trichlor-2-ketonu je první částí Coreyovy–Linkovy reakce, sloužící k přípravě aminokyselin a podobných sloučenin s možností dosažení přirozené i nepřirozené stereochemie a mnoha různých postranních řetězců.
Asymetrickou redukcí 7-(benzyloxy)hept-1-en-3-oneu se tvoří (S)-7-(benzyloxy)hept-1-en-3-ol, chirální alkohol používaný na přípravu kanamienamidů, zkoumaných jako enolethery obsahující enamidové skupiny, které mají potenciál k potlačování růstu rakovinných buněk. Chirální produkt se získává s využitím (R)-CBS katalyzátoru, přičemž se dosahuje 89% výtěžnosti a 91% enantiomerního přebytku.[21]
Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Coreyova–Itsunova redukce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Coreyova–Itsunova redukce na Wikimedia Commons
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Corey–Itsuno reduction na anglické Wikipedii.
- ↑ a b A. Hirao; S. Itsuno; S. Nakahama; N. Yamazaki. Asymmetric reduction of aromatic ketones with chiral alkoxy-amineborane complexes. Journal of the Chemical Society, Chemical Communications. S. 315. DOI 10.1039/C39810000315.
- ↑ a b E. J. Corey; R. K. Bakshi; S. Shibata. Highly enantioselective borane reduction of ketones catalyzed by chiral oxazaborolidines. Mechanism and synthetic implications. Journal of the American Chemical Society. 1987, s. 5551–5553. DOI 10.1021/ja00252a056.
- ↑ a b E. J. Corey; R. K. Bakshi; S. Shibata; C. P. Chen; V. K. Singh. A stable and easily prepared catalyst for the enantioselective reduction of ketones. Applications to multistep syntheses. Journal of the American Chemical Society. 1987, s. 7925–7926. DOI 10.1021/ja00259a075.
- ↑ L. Deloux; M. Srebnik. Asymmetric boron-catalyzed reactions. Chemical Reviews. 1993, s. 763–784. DOI 10.1021/cr00018a007.
- ↑ a b c d e f g h E. J. Corey; C. J. Helal. Reduction of Carbonyl Compounds with Chiral Oxazaborolidine Catalysts: A New Paradigm for Enantioselective Catalysis and a Powerful New Synthetic Method. Angewandte Chemie International Edition. 1998, s. 1986–2012. DOI 10.1002/(sici)1521-3773(19980817)37:15<1986::aid-anie1986>3.0.co;2-z. PMID 29711061.
- ↑ a b B. T. Cho. Recent advances in the synthetic applications of the oxazaborolidine-mediated asymmetric reduction. Tetrahedron. 2006, s. 7621–7643. DOI 10.1016/j.tet.2006.05.036.
- ↑ Corey, E. J.; AZIMIOARA, M.; SARSHAR, S. X-Ray crystal structure of a chiral oxazaborolidine catalyst for enantioselective carbonyl reduction. Tetrahedron Letters. 1992, s. 3429–3430. DOI 10.1016/s0040-4039(00)92654-6.
- ↑ D. Evans. Stereoselective organic reactions: catalysts for carbonyl addition processes. Science. 1988, s. 420–426. DOI 10.1126/science.3358127. PMID 3358127. Bibcode 1988Sci...240..420E.
- ↑ D. K. Jones; D. C. Liotta; I. Shinkai; D. J. Mathre. Origins of the enantioselectivity observed in oxazaborolidine-catalyzed reductions of ketones. The Journal of Organic Chemistry. 1993, s. 799–801. DOI 10.1021/jo00056a001.
- ↑ E. J. Corey. New enantioselective routes to biologically interesting compounds. Journal of the American Chemical Society. 1990, s. 1209–1216. DOI 10.1351/pac199062071209.
- ↑ V. Nevalainen. Quantum chemical modeling of chiral catalysis. Part 15. On the role of hydride-bridged borane - alkoxyborane complexes in the catalytic enantioselective reduction of ketones promoted by chiral oxazaborolidines. Tetrahedron: Asymmetry. 1994, s. 289–296. DOI 10.1016/s0957-4166(00)86186-8.
- ↑ G. J. Quallich; J. F. Blake; T. M. Woodall. A combined synthetic and ab initio study of chiral oxazaborolidines structure and enantioselectivity relationships. Journal of the American Chemical Society. 1994, s. 8516–8525. DOI 10.1021/ja00098a012.
- ↑ a b G. J. Quallich; T. M. Woodall. Enantioselective oxazaborolidine reduction of ketones containing heteroatoms. Tetrahedron Letters. 1993, s. 785–788. DOI 10.1016/0040-4039(93)89012-f.
- ↑ a b Jones, T. K.; MOHAN, J. J.; XAVIER, L. C.; BLACKLOCK, T. J.; MATHRE, D. J.; SOHAR, P.; JONES, E. T. T. An asymmetric synthesis of MK-0417. Observations on oxazaborolidine-catalyzed reductions. The Journal of Organic Chemistry. 1991, s. 763–769. DOI 10.1021/jo00002a050.
- ↑ Michael Bulliard. Handbook of Chiral Chemicals. Příprava vydání David Ager. [s.l.]: Marcel Decker, 1999. Dostupné online. ISBN 0824710584. Kapitola Chapter 11.1: Asymmetric Reduction of Prochiral Ketones Catalyzed by Oxazaborolidines, s. 211–225.
- ↑ E. J. Corey; J. O. Link. A new chiral catalyst for the enantioselective synthesis of secondary alcohols and deuterated primary alcohols by carbonyl reduction. Tetrahedron Letters. 1989, s. 6275–6278. DOI 10.1016/s0040-4039(01)93871-7.
- ↑ E. J. Corey; R. K. Bakshi. A new system for catalytic enantioselective reduction of achiral ketones to chiral alcohols. Synthesis of chiral α-hydroxy acids. Tetrahedron Letters. 1990, s. 611–614. DOI 10.1016/s0040-4039(00)94581-7.
- ↑ S. M. Nettles; K. Matos; E. R. Burkhardt; D. R. Rouda; J. A. Corella. Role of NaBH 4 Stabilizer in the Oxazaborolidine-Catalyzed Asymmetric Reduction of Ketones with BH 3 - THF. The Journal of Organic Chemistry. 2002, s. 2970–2976. DOI 10.1021/jo016257c. PMID 11975554.
- ↑ Rajendra D. Mahale; Sudhir P. Chaskar; Kiran E. Patil; Golak C. Maikap; Mukund K. Gurjar. Corey–Itsuno Reduction of Ketones: A Development of Safe and Inexpensive Process for Synthesis of Some API Intermediates. Organic Process Research & Development. 2012, s. 710–713. DOI 10.1021/op300034u. PMID 11975554.
- ↑ R. T. Stemmler. CBS Oxazaborolidines - Versatile Catalysts for Asymmetric Synthesis. Synlett. 2007, s. 0997–0998. DOI 10.1055/s-2007-973876.
- ↑ D. Prabhakar Reddy; Ning Zhang; Zhimei Yu; Zhen Wang; Yun He. Total Synthesis of Kanamienamide. The Journal of Organic Chemistry. 2017-10-02, s. 11262–11268. ISSN 0022-3263. DOI 10.1021/acs.joc.7b01984. PMID 28944669.
