Stannyleny

Stannyleny jsou organické sloučeniny cínu s obecným vzorcem R2Sn:, patřící mezi analogy karbenů. Na rozdíl od karbenů, jejichž základní stavy bývají tripletové, jsou základní stavy stannylenů singletové, protože valenční orbitaly cínu jsou méně náchylné k hybridizaci a elektrony v orbitalech 5s jsou tak stále spárované.[1]
Stannyleny bývají nestabilní, ale lze je stabilizovat sterickými efekty. Popsány jsou i jejich adukty s Lewisovými zásadami.[2]
Historie[editovat | editovat zdroj]
Prvním stabilním stannylenem byl [(Me3Si)2CH]2Sn, popsaný Michaelem F. Lappertem v roce 1973;[3] stejným způsobem byl o rok později získán i první diamidostannylen [(Me3Si)2N]2Sn.[4]
Nestálý stannylen Me2Sn byl vytvořen tepelným rozkladem cyklo-(Me2Sn)6.[5]
Příprava[editovat | editovat zdroj]
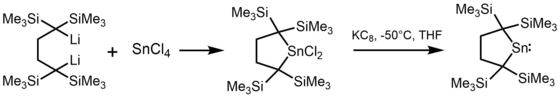
Příprava stabilních stannylenů[editovat | editovat zdroj]
Většina alkylstannylenů se získává alkylacemi cínatých halogenidů organolithnými sloučeninami, například první stannylen, [(Me3Si)2CH]2Sn, byl vytvořen pomocí (Me3Si)2CHLi a SnCl2.[3]
Některé stannyleny lze připravit redukcemi cíničitých sloučenin s KC8[6]
Amidostannyleny je možné vytvořit reakcemi cínatých halogenidů s amidem lithným.[4]
Příprava nestabilních stannylenů[editovat | editovat zdroj]
Izolace nestálých alkylstannylenů je obtížnější. První izolace dimethylstannylenu měla být provedena termolýzou cyklostannanu (Me2Sn)6, vzniklého kondenzací Me2Sn(NEt2)2 a Me2SnH2. Důkazy o jeho vzniku byly získané prostřednictvím vibračních frekvencí v infračervené spektroskopii a odpovídaly vypočteným hodnotám.[5]
Existence těchto sloučenin typu SnMe2 byla poté potvrzena objevem absorpce ve viditelném světle odpovídající vypočteným elektronovým přechodům SnMe2 v plynné fázi.[7]
Dalším způsobem přípravy nestabilních stannylenů je laserová fotolýza tetraalkylcínových sloučenin, například SnMe4. Tvorbu stannylenu lze pozorovat ultrafialovo-viditelnou spektroskopií.[8]
Struktura[editovat | editovat zdroj]

Stannyleny lze považovat za sp2-hybridizované sloučeniny s prázdnými orbitaly 5p a volným elektronovým párem. Jejich červené zbarvení způsobují n-p přechody.[3][9]
Některé ligandy mohou zmírnit nedostatek elektronů u monomerních stannylenů omezením agostických interakcí vazeb B-H. Tuto možnost v roce 2006 potvrdil Mark Kenyon se spolupracovníky přípravou cyklického dialkylstannylenu [{n-Pr2P(BH3)}(Me3Si)CCH2]2Sn. Krystalová struktura sloučeniny obsahovala jednu vazbu B-H uspořádanou ve směru k atomu Sn, s délkou 203 pm. Snížení nedostatku elektronů na Sn potvrdila spektroskopická data, obzvláště pak 119Sn NMR, ukazující velmi nízký chemický posun (587 a 787 ppm oproti 2323 ppm u odpovídajícího dialkylstannylenu), což ukazovalo na vyšší elektronovou hustotu okolo Sn.[10]
Reakce[editovat | editovat zdroj]
Oligomerizace[editovat | editovat zdroj]
Malé a nestálé stannyleny, jako je dimethylstannylen, se oligomerizují na cyklické oligostannany, které lze použít jako zdroje stannylenů.[5]
Objemnější stannyleny, například Lappertův stannylen, oproti tomu vytvářejí dimery. Vlastnosti vazeb Sn-Sn u těchto dimerů se liší od vazeb C-C v dimerech karbenů, jako jsou alkeny. Alkeny obsahují typické dvojné vazby a jejich molekuly jsou rovinné, zatímco dimery stannylenů mají molekuly s ohnutým tvarem. Dvojné vazby v dimerech stannylenů lze považovat za dvě donor-akceptorové vazby. Analýza elektronové lokalizační funkce zde ukazuje u obou atomů Sn elektrony ve vazebných orbitalech, což naznačuje, že interakce mezi atomy Sn jsou dvojicí neobvykle ohnutých vazeb.[11] Stabilitu dimerů stannylenů také ovlivňuje sterické odpuzování jednotlivých substituentů.[12]

Inserční reakce[editovat | editovat zdroj]
Alkylstannyleny mohou reagovat s řadou různých sloučenin (alkylhalogenidy, enony, dieny) v oxidačních adicích a insercích. Reakcí stannylenu s 9,10-fenantrolindionem vznikal EPR signál identifikovaný jako 9,10-fenantrendionový radikálový anion, což naznačuje, že reakce probíhá radikálovým mechanismem.[13]

Cykloadice[editovat | editovat zdroj]
I když jsou stannyleny stabilnější než jejich lehčí karbenové analogy, tak snadno vstupují do [2+4] cykloadičních reakcí se Z-alkeny. Adice (CH(SiMe3)2)2Sn na 2,7-difenylokta-2,3,5,6-tetraen probíhá cheletropně, protože takový průběh umožňují Woodwardova-Hoffmannova pravidla.[14]

Kovová centra v oxidačních adicích a redukčních eliminacích[editovat | editovat zdroj]
Vlastnosti páru SnII/SnIV u některých stannylenů připomínají přechodné kovy. Na jejich reaktivit v oxidačních adicích má velký vliv energie oddělení singletu od tripletu,[15] kde vytváří silný σ-donorový borylový (-BX2) ligand. Na cín lze oxidačně adovat nejen molekulární vodík. ale i vazby E-H bond (E = B, Si, O, N). U amoniaku a vody může produkt oxidační adice vstoupit do redukční eliminace, kterou vzniká vazba O-B nebo N-B.[16]

Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Stannylene na anglické Wikipedii.
- ↑ T. Sasamori; N. Tokitoh. Encyclopedia of Inorganic Chemistry II. Chichester: John Wiley & Sons, 2005. S. 1698–1740.
- ↑ Yoshiyuki Mizuhata; Takahiro Sasamori; Norihiro Tokitoh. Stable Heavier Carbene Analogues. Chemical Reviews. 2009, s. 3479–3511. DOI 10.1021/cr900093s. PMID 19630390.
- ↑ a b c Peter J. Davidson; Michael F. Lappert. Stabilisation of Metals in a Low Co-ordinative Environment using the Bis(trimethylsilyl)methyl Ligand; Coloured SnII and PbII Alkyls, M[(Me3Si)2CH]2. Journal of the Chemical Society, Chemical Communications. 1973, s. 317. DOI 10.1039/C3973000317A.
- ↑ a b David H. Harris; Michael F. Lappert. Monomeric, volatile bivalent amides of group IVB elements, M(NR12)2 and M(NR1R2)2(M=Ge, Sn, or Pb; R1=Me3Si, R2=Me3C). Journal of the Chemical Society, Chemical Communications. 1974, s. 895–896. DOI 10.1039/C39740000895.
- ↑ a b c Paul Bleckmann; Hartwig Maly; Rolf Minkwitz; Barbel Watta; Wilhelm P. Neumann. Matrix Isolation and IR Spectroscopy of Stannylenes (CH3)2Sn and (CD3)2Sn. Tetrahedron Letters. 1982, s. 4655–4658. DOI 10.1016/s0040-4039(00)85679-8.
- ↑ Mitsuo Kira; Shintaro Ishida; Takeaki Iwamoto; Rika Yauchibara; Hideki Sakurai. New synthesis of a stable dialkylstannylene and its reversible complexation with tetrahydrofuran. Journal of Organometallic Chemistry. 2001, s. 144–147. DOI 10.1016/s0022-328x(01)00998-6.
- ↑ Robin Walsh. First Gas-Phase Detection of Dimethylstannylene and Time-Resolved Study of Some of Its Reactions. Journal of the American Chemical Society. 2002, s. 7555–7562. DOI 10.1021/ja012691k. PMID 12071766.
- ↑ Rosa Becerra; Peter P. Gaspar; Cameron Harrington; William J. Leigh; Ignacio Vargas-Baca; Robin Walsh; Dong Zhou. Direct Detection of Dimethylstannylene and Tetramethyldistannene in Solution and the Gas Phase by Laser Flash Photolysis of 1,1-Dimethylstannacyclopent-3-enes. Journal of the American Chemical Society. 2005, s. 17 469 – 17 478. DOI 10.1021/ja052675d. PMID 16332099.
- ↑ Alwyn G. Davies. Organotin Chemistry. Weinheim: Wiley-VCH, 2004. Dostupné online. ISBN 3-527-31023-1. S. 364.
- ↑ Keith Izod. Stabilization of a Dialkylstannylene by Unusual B-H Sn ç-Agostic-Type Interactions. A Structural, Spectroscopic, and DFT Study. Organometallics. 2006, s. 1135–1143. DOI 10.1021/om0600036.
- ↑ Paul L. A. Popelier; Nathaniel O. J. Malcolm; Ronald J. Gillispie. A topological study of homonuclear multiple bonds between the elements of group 14. Journal of the Chemical Society, Dalton Transactions. 2002, s. 3333–3341. DOI 10.1039/B110610B.
- ↑ Aleš Růžička; Pavel Hobza. New Insight into the Nature of Bonding in the Dimers of Lappert's Stannylene and Its Ge Analogs: A Quantum Mechanical Study. Journal of Chemical Theory and Computation. 2016, s. 1696–1704. DOI 10.1021/acs.jctc.6b00065. PMID 26953594.
- ↑ a b Colin Eaborn; J. David Smith. Reactions of a Highly Crowded Cyclic Stannylene with Iodoalkanes, Enones, and Dienes. Inhibition of Nucleophilic Substitution at Tin(IV) Centers. Organometallics. 2002, s. 2430–2437. DOI 10.1021/om020106y.
- ↑ Wilhelm P. Neumann. [2+4] Cheletropic cycloaddition of stannylenes R2Sn. Tetrahedron Letters. 1984, s. 625–628. DOI 10.1016/S0040-4039(00)99955-6.
- ↑ Yong Wang; Jing Ma. Silylenes and germylenes: The activation of H–H bond in hydrogen molecule. Journal of Organometallic Chemistry. 2009, s. 2567–2575. DOI 10.1016/j.jorganchem.2009.03.051.
- ↑ a b Andrey Protchenko; Simon Aldridge. Enabling and Probing Oxidative Addition and Reductive Elimination at a Group 14 Metal Center: Cleavage and Functionalization of E−H Bonds by a Bis(boryl)stannylene. Journal of the American Chemical Society. 2016, s. 4555–4564. DOI 10.1021/jacs.6b00710. PMID 26981766.
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Stannyleny na Wikimedia Commons
Obrázky, zvuky či videa k tématu Stannyleny na Wikimedia Commons