Fenolftalein: Porovnání verzí
Bez shrnutí editace |
m r2.7.2+) (Robot: Přidávám be:Фенолфталеін |
||
| Řádek 80: | Řádek 80: | ||
[[ar:فينول فثالين]] |
[[ar:فينول فثالين]] |
||
[[be:Фенолфталеін]] |
|||
[[bg:Фенолфталеин]] |
[[bg:Фенолфталеин]] |
||
[[bs:Fenolftalein]] |
[[bs:Fenolftalein]] |
||
Verze z 2. 3. 2013, 07:14
Šablona:Infobox Chemická sloučenina
Fenolftalein je organická aromatická sloučenina. Často se používá při acidobazických titracích jako indikátor.
Výroba
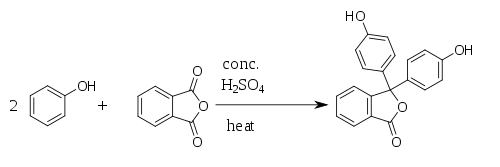
Fenolftalein byl poprvé připraven roku 1871 německým chemikem Adolf von Baeyerem reakcí fenolu s ftalanhydridem, z čehož pochází název fenolftalein. Reakce probíhá za katalýzy kyseliny sírové a za tepla (nesmí dojít k přehřátí, protože by se rozpadal ftalanhydrid). Při reakci vzniká jako vedlejší produkt voda.
Titrace
Při acidobazických titracích se využívá barevného přechodu fenolftaleinu při změně pH. V kyselém prostředí je fenolftalein bezbarvý, v bazickém prostředí se zbarví fialově. K přechodu dochází při pH 8,2-9,8. Fenolftalein se používá ve formě roztoku v ethanolu.
Užití
Fenoltalein se používá jako projímadlo. V současné době se od jeho použití ustupuje z důvodu možné karcinogenity.
Fenolftalein společně s peroxidem vodíku se používá při testování přítomnosti krve, tzv. Kastle-Meyerův test.
Další použití nachází při výrobě hraček, např. mizejících inkoustů. Inkoust je smíchán s hydroxidem sodným, který reaguje se vzdušným oxidem uhličitým. Při reakci vzniká uhličitan sodný a klesá pH inkoustu. Pokles pH způsobí přechod fenolftaleinu z fialové do bezbarvé formy.

V tomto článku byl použit překlad textu z článku Phenolphtalein na anglické Wikipedii.