Komplexy přechodných kovů s dikyslíkem
Komplexy dikyslíku jsou komplexní sloučeniny, které obsahují dikyslíkové (O2) ligandy.[1][2]
K těmto sloučeninám patří proteiny přenášející kyslík, jako jsou myoglobin, hemoglobin, hemerythrin a hemokyanin.[3]
Komplexy s O2 tvoří řada přechodných kovů a tvorba mnohých takových komplexů je vratná.[4]
Navázání O2 na kov je součástí řady důležitých procesů, jako jsou buněčné dýchání a koroze, a má velký význam v chemickém průmyslu. První umělý komplex dikyslíku byl připraven v roce 1938, šlo o kobaltnatý komplex s vratně navázaným O2.[5]
Jednojaderné komplexy O2
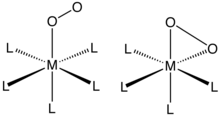
[editovat | editovat zdroj]O2 se na kov může vázat dvěma způsoby a vytvářet tak (η1-) nebo (η2-)komplexy. Struktury těchto sloučenin lze často určit rentgenovou krystalografií, kde je možné zjistit celkovou geometrii i délky vazeb O–O, a tím i řád vazby O2 ligandů.
Komplexy η1-O2 ligandů
[editovat | editovat zdroj]
Vazby typu η1-O2 se vyskytují v kobaltnatých a železnatých komplexech porfyrinů (a podobných aniontových makrocyklických ligandů). Významnými příklady jsou myoglobin a hemoglobin, je také známa řada syntetických analogů s podobnými vlastnostmi. Navázání O2 se často popisuje jako přesun elektronů z dvojmocného kovového centra za vzniku superoxidového (O
2 ) komplexu trojmocného kovu. Jak je znázorněno u cytochromu P450, tak vazba Fe-η1-O2 vyvolává tvorbu železičitých oxocenter. O2 se může vázat na jeden kov dvouatomového centra, a to podobným způsobem, jako je uveden výše; například aktivní místo proteinu hemerythrinu obsahuje karboxylát diželeza, navazující se na O2 na jednom Fe centru. Do vazeb se mohou zapojovat i dvojjaderné komplexy, přestože úvodní atak O2 probíhá pravděpodobně na jediném kovu.
Komplexy η2-O2 ligandů
[editovat | editovat zdroj]η2-vazby jsou v komplexech dikyslíku nejběžnější. Tyto komplexy lze připravit reakcemi komplexů kovů v nízkých oxidačních číslech s kyslíkem; například se O2 může vratně vázat na Vaskův komplex (Ph = C6H5):
- IrCl(CO)(PPh3)2 + O2 ⇌ IrCl(CO)(PPh3)2O2
Přeměna se popisuje jako 2 e− redoxní reakce: Ir+ se mění na Ir3+ a dikyslík se současně stává peroxidem. Protože má O2 tripletový základní stav a Vaskův komplex je singlet, tak je reakce pomalejší, než za použití singletového kyslíku.[7]
Magnetické vlastnosti některých η2-O2 komplexů naznačují, že ligandem je ve skutečnosti superoxid namísto peroxidu.[8]
Většina η2-komplexů O2 vytvářených pomocí peroxidu vodíku neobsahuje O2, například chromany ([CrO4)]2−) mohou být přeměněny na tetraperoxochromany [Cr(O2)4]2−. Reakcemi peroxidu vodíku s vodnými roztoky titaničitých solí vznikají výrazně zabarvené peroxykomplexy, jejich tvorbu lze použít na důkaz přítomnosti titaničitých iontů nebo peroxidu vodíku.[9]
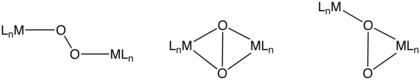
Dvojjaderné komplexy O2
[editovat | editovat zdroj]
Dvojjaderné komplexy dikyslíku mají vazby typu μ2-η2,η2-, μ2-η1,η1-, μ2-η1 aη2-. V závislosti na počtu elektronů přesunutých z dikovového jádra mohou být tyto O2 ligandy popsány jako peroxo nebo superoxo. Hemokyanin je přenašečem O2, který obsahuje můstkové O2 ligandy a součástí jeho struktury je dvojice měďných center.[10]

Prvním umělým přenašečem kyslíku byl salkomin, kobaltnatý komplex salenu.[5] Solvatované deriváty pevného komplexu na sebe navazují 0,5 ekvivalentů O2:
- 2 Co(salen) + O2 → [Co(salen)]2O2
U některých dvojjaderných komplexů O2 byly pozorovány vratné přenosy elektronů.[12]

Ostatní kyslíkové ligandy a jejich využití
[editovat | editovat zdroj]Komplexy dikyslíku mohou sloužit k přípravě dalších komplexů s kyslíkatými ligandy. Oxokomplexy lze připravit štěpením vazeb O–O po komplexaci. Hydroperoxokomplexy se vytváří v průběhu redukcí dikyslíkových komplexů pomocí kovů. Redukce O2 kovovými katalyzátory jsou důležitými poloreakcemi v palivových článcích.
Kovy katalyzované oxidace pomocí O2 mají jako meziprodukty komplexy dikyslíku, vlastními oxidanty jsou ale často oxokomplexy. Vratné navazování kyslíku na komplexy kovů lze použít k přečištění vzdušného kyslíku, kde se ovšem většinou používá destilace zkapalněného vzduchu.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Transition metal dioxygen complex na anglické Wikipedii.
- ↑ Gereon M. Yee; William B. Tolman. Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Příprava vydání Peter M. H. Kroneck, Martha E. Sosa Torres. [s.l.]: Springer, 2015. DOI 10.1007/978-3-319-12415-5_5. PMID 25707468. Kapitola Chapter 5: Transition Metal Complexes and the Activation of Dioxygen, s. 131–204.
- ↑ A. F. Holleman; E. Wiberg. Inorganic Chemistry. San Diego, CA: Academic Press, 2001. ISBN 0-12-352651-5.
- ↑ S. J. Lippard; J. M. Berg. Principles of Bioinorganic Chemistry. Mill Valley, CA: University Science Books, 1994. Dostupné online. ISBN 0-935702-73-3.
- ↑ R. E. Berry. Comprehensive Coordination Chemistry II. [s.l.]: [s.n.], 2004. ISBN 9780080437484. DOI 10.1016/B0-08-043748-6/01161-0. Kapitola Reactivity and Structure of Complexes of Small Molecules: Dioxygen, s. 625–629.
- ↑ a b Tokuichi Tsumaki. Nebenvalenzringverbindungen. IV. Über einige innerkomplexe Kobaltsalze der Oxyaldimine. Bulletin of the Chemical Society of Japan. 1938, s. 252–260. DOI 10.1246/bcsj.13.252.
- ↑ S. J. Lippard, J. M. Berg “Principles of Bioinorganic Chemistry” University Science Books: Mill Valley, CA; 1994. ISBN 0-935702-73-3
- ↑ M. Selke; C. S. Foote. Reactions of Organometallic Complexes with Singlet Oxygen. Photooxidation of Vaska's Complex. Journal of the American Chemical Society. 1993, s. 1166–1167. DOI 10.1021/ja00056a061.
- ↑ James W. Egan; Brian S. Haggerty; Arnold L. Rheingold; Shawn C. Sendlinger; Klaus H. Theopold. Crystal structure of a side-on superoxo complex of cobalt and hydrogen abstraction by a reactive terminal oxo ligand. Journal of the American Chemical Society. 1990, s. 2445–2446. DOI 10.1021/ja00162a069.
- ↑ N. N. Greenwood; A. Earnshaw. Chemistry of the Elements. Oxford: Butterworth-Heinemann, 1997. ISBN 0-7506-3365-4.
- ↑ Courtney E. Elwell; Nicole L. Gagnon; Benjamin D. Neisen; Debanjan Dhar; Andrew D. Spaeth; Gereon M. Yee; William B. Tolman. Copper–Oxygen Complexes Revisited: Structures, Spectroscopy, and Reactivity. Chemical Reviews. 2017, s. 2059–2107. DOI 10.1021/acs.chemrev.6b00636. PMID 28103018.
- ↑ M. Calligaris; G. Nardin; L. Randaccio; A. Ripamonti. Structural Aspects of the Synthetic Oxygen-Carrier NN′-Ethylenebis(Salicylideneiminato)cobalt(II): Structure of the Addition Compound with Oxygen Containing Dimethylformamide. Journal of the Chemical Society A. 1970, s. 1069. DOI 10.1039/j19700001069.
- ↑ William Palzer Schaefer. Structure of Decaammine-μ-Peroxo-Dicobalt Disulfate Tetrahydrate. Inorganic Chemistry. 1968, s. 725–731. DOI 10.1021/ic50062a022.