Metastabilita
Metastabilita je slabá forma stability. Metastabilní stav je stabilní vůči malým změnám, ale nestabilní vůči větším změnám. Pojem se objevuje zejména ve fyzice a v chemii.


Příkladem toho je systém dřeva a vzdušného kyslíku při pokojové teplotě: Z termodynamického hlediska by samovolné spálení chemicky vázaného uhlíku s kyslíkem za vzniku oxidu uhličitého vedlo ke stabilnějšímu stavu. Bez aktivace, tedy dostatečně velké dodané energie umožňující zapálení dřeva, k tomu nedojde.
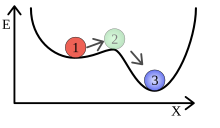
Podobné situace ilustruje obrázek vpravo: Míč leží v malé prohlubni na horském svahu. Pokud je míč v prohlubni jen mírně vychýlen, kutálí se zpět do jejího nejhlubšího bodu. Ten představuje lokální minimum. Pokud se ale vychýlí více, může se kutálet po úbočí hory a dosáhnout globálního minima. Než se změní stav systému, musí být nejprve aplikována energie přesahující určitý práh.
Metastabilní systémy mají vyšší energii (volnou entalpii) než stabilní fáze. Přesto se do stabilní fáze spontánně nemohou dostat vůbec nebo jen pomalu. Toho lze využít např. k uskladnění energie.
Příkladem metastabilní fáze hmoty je diamant, který by se měl spontánně přeměnit na grafit; rychlost tohoto procesu je však při pokojové teplotě zanedbatelná. Dalším příkladem je cínový mor: kovová fáze cínu se stává metastabilní pod 13 °C a pomalu se přeměňuje na nekovovou fázi, která je při těchto teplotách stabilnější. Dalšími příklady jsou podchlazená voda, sklo (nejstabilnějším stavem by byly krystalické křemičitany) a přesycené roztoky, jako jsou ty, které se používají v ohřívačích rukou.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Metastabilität na německé Wikipedii.
