2,3-Wittigův přesmyk
2,3-Wittigův přesmyk je organická reakce spočívající v přeměně allylového etheru na allylový alkohol pericyklickou reakcí. Reakce probíhá soustředěným mechanismem a tak může být uskutečněna s vysokou stereoselektivitou a použita jako součást stereoselektivní syntézy různých sloučenin. Reakce probíhá pouze v silně zásaditém prostředí a vytváří se při ní karboaniontový meziprodukt. Vedlejší reakcí je [1,2]-Wittigův přesmyk. [2,3] sigmatropní přesmyky probíhají u sloučenin s mnoha různými skupinami X a Y. Pokud je X karboanion a Y alkoxid, jedná se o [2,3]-Wittigův přesmyk a produkty jsou pent-1-en-5-oly. Při [1,2]-Wittigově přesmyku vznikají pent-5-en-1-oly; tento druh reakce se vyskytuje společně s [2,3]-přesmykem a objevuje se při vyšších teplotách.[1] Díky vysokým výtěžnostem a stereoselektivitě jsou [2,3]-Wittigovy přesmyky používány poměrně často. Karboanion se tvoří přímou lithiací středně kyselých substrátů, transmetalací ze sloučenin cínu nebo redukční lithiací O,S-acetalů. K dosažení stereoselektivity se mohou použít chirální reaktanty, ale také izolace jednotlivých diastereomerů.
(1)

Mechanismus a stereochemie[editovat | editovat zdroj]
Převažující mechanismus[editovat | editovat zdroj]
Po vzniku karboaniontu probíhá [2,3]-Wittigův přesmyk za nízkých teplot rychle a selektivně. Pokud se ovšem reakční směs zahřeje nad −60 °C, tak začne také probíhat [1,2]-Wittigův přesmyk.[2]
(2)

Navržený přechodný stav má pětičlennou obálkovitou strukturu.[3]
Skupina navázaná na karboanion (G) může zaujmout pseudoekvatoriální i pseudoaxiální polohu, pseudoekvatoriální obvykle převládá. Větší substituenty na opačné straně etherového kyslíku přednostně zaujímají exo pozici (RE), čímž zamezují A1,3 napětí; to způsobuje, že ze syn-reaktantů vznikají hlavně (Z)-produkty a z anti-reaktantů (E)-produkty. Toto pravidlo má však několik výjimek.[4]
(3)

Stereoselektivní provedení[editovat | editovat zdroj]
Stereoselektivity lze při [2,3]-Wittigových přesmycích dosáhnout třemi způsoby. Prvním z nich je diastereoselekce založená na již existuijícím chirálním centru, druhým navázání chirálního pomocníka na výchozí látku a třetím použití chirální zásady. Tyto postupy fungují jen u některých G skupin, ovšem produkty se rvoří s vysokou výtěžností, protože není třeba odstraňovat či pozměňovat žádnou skupinu navázanou na chirálního pomocníka. Stereocentrum naproti karbaniontu obvykle musí být terciární, aby došlo k napojení největšího substituentu do polohy RE.[5]
(4)
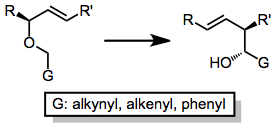
Asymetrická indukce je založená na stereocentrech, která jsou přítomna ve výchozí látce a nejsou ovlivněna reakcí. Účinného provedení reakce tímto způsobem lze dosáhnout jak jejich navázáním na G skupinu,[6] tak i pomocí substituentu navázaného na konec dvojné vazby.[7] Při těchto variantách jsou běžné molární poměry diastereomerů okolo 90:10, odstranění chirálních pomocníků může však být obtížné.[8]
(5)

Enantiomerně obohacené produkty lze v některých případech získat použitím chirálních zásad,[9] obecně však takovýto postup nefunguje. Enantioselektivita těchto reakcí bývá často velmi nízká, což naznačuje, že spojení mezi konjugovanou kyselinou příslušné zásady a přesmykujícím se karboaniontem je slabé.
(6)

Přehled a omezení[editovat | editovat zdroj]
Při Wittigově přesmyku lze použít mnoho různých allyletherů - hůlavním požadavkem je, aby mholy ze substrátu vytvořit potřebný karboanion. Toho lze dosáhnout pomocí kyselého hydroxylu, redukovatelné funkční skupiny nebo vazby kov-uhlík. Ke zvýšení kyselosti protonu lze použít alkenylovou, alkynylovou nebo fenylovou skupinu. Je možné použít nesubstituované koncové alkeny, i když při použití silylovaných alkenů se dosahuje vyšší výtěžnosti.[10]
(7)
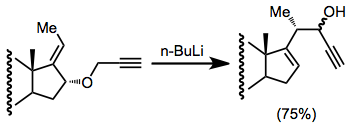
Pokud je na alken navázána stabilizující skupina G, tak se stereoselektivita také zvýší. Skupiny stabilizující anionty, jako jsou (trimethyl)silyl a methylthio, obvykle zajišťují dobrou selektivitu.[11]
(8)

Ke stabilizaci aniontů lze použít i karbonylové skupiny, pokud se při reakci využívá chirální pomocník.[12]
(9)

Je známa velice selektivní metoda využíjvající karbonyly chromu ke stabilizaci aniontů.[13]
(10)

Nutnost přítomnosti kyselých vodíků na etherovém kyslíku je výrazným omezením této reakce. Byly tak vyvinuty transmetalační metody, které umožnily stereoelektivní tvorbu karboaniontů z vazeb uhlík-cín. Možnosti reakce tak byly výrazně rozšířeny.[4]
(11)

Využití[editovat | editovat zdroj]
Produkty [2,3]-Wittigova přesmyku bis(allyl)etherů jsou 1,5-dien-3-oly. Tyto sloučeniny mohou vstupovat do oxy-Copeových přesmyků po deprotonaci a vytvořit tak δ,ε-nenasycené karbonylové sloučeniny. Tímto způsobem byly [2,3]-Wittigovy přesmyky zahrnuty do přípravy několika přírodních látek, jako jsou například brevikomin a oxokrinol.[14]
(12)

Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku 2,3-Wittig rearrangement na anglické Wikipedii.
- ↑ J. E. Baldwin; J. E. Patrick. Stereochemistry of [2,3]-sigmatropic reactions. Wittig rearrangement. Journal of the American Chemical Society. 1971, s. 3556. DOI 10.1021/ja00743a060.
- ↑ U. Schollkopf; K. Fellenberger; M. Rizk. 1.2-Wanderungen zum Atom mit freiem Elektronenpaar, VIII.ortho-Isomerisation bei anionisierten Äthern und Wanderungsmechanismus eines Propargyl-Restes bei der Wittig-Umlagerung. Liebigs Annalen. 1970, s. 106–115. DOI 10.1002/jlac.19707340111.
- ↑ K. Mikami; Y. Kimura; N. Kishi; T. Nakai. Acyclic diastereoselection of the [2,3]-Wittig sigmatropic rearrangement of a series of isomeric crotyl ethers. A conceptual model for the transition-state geometry. The Journal of Organic Chemistry. 1983, s. 279. DOI 10.1021/jo00150a033.
- ↑ a b W. C. Still; A. Mitra. A highly stereoselective synthesis of Z-trisubstituted olefins via [2,3]-sigmatropic rearrangement. Preference for a pseudoaxially substituted transition state. Journal of the American Chemical Society. 1978, s. 1927. DOI 10.1021/ja00474a049.
- ↑ N. Sayo; K. Azuma; K. Mikami; T. Nakai. Acyclic stereocontrol via asymmetric [2,3]-Wittig rearrangement with high enantio- and erythro-selectivity and its use in the chiral synthesis of insect pheromones. Tetrahedron Letters. 1984, s. 565. DOI 10.1016/S0040-4039(00)99939-8.
- ↑ K. Mikami; K. Fujimoto; T. Kasuga; T. Nakai. Asymmetric [2,3]Wittig sigmatropic rearrangement involving a chiral azaenolate as the migrating terminus. A simple synthesis of (+)-verrucarinolactone. Tetrahedron Letters. 1984, s. 6011. DOI 10.1016/S0040-4039(01)81746-9.
- ↑ H. Priepke; R. Bruckner; K. Harms. Asymmetric Induction in the Wittig-Still Rearrangement of Ethers Containing an Allylic Stereocenter – Diastereocontrol by Allylic Nitrogen. Chemische Berichte. 1990, s. 555. DOI 10.1002/cber.19901230323.
- ↑ L. A. Paquette; J. Wright; G. J. Drtina; R. A. Roberts. Enantiospecific total synthesis of natural (−)-retigeranic acid a and two (−)-retigeranic acid B candidates. The Journal of Organic Chemistry. 1987, s. 2960. DOI 10.1021/jo00389a070.
- ↑ J. A. Marshall; J. Lebreton. Enantioselective synthesis of macrocyclic propargylic alcohols by [2,3] Wittig ring contraction. Synthesis of (+)-aristolactone and cembranoid precursors. Journal of the American Chemical Society. 1988, s. 2925. DOI 10.1021/ja00217a039.
- ↑ L. Castedo; J. R. Granja; A. Mourino. (2,3)-Wittig sigmatropic rearrangements in steroid synthesis. New stereocontrolled approach to steroidal side chains at C-20. Tetrahedron Letters. 1985, s. 4959. DOI 10.1016/S0040-4039(00)94997-9.
- ↑ K. Mikami; N. Kishi; T. Nakai. Silicon-directed regiocontrol in Witting rearrangements of bis-allyl ethers and allyl propargyl ethers. Chemical Letters. 1989, s. 1683–1686. DOI 10.1246/cl.1989.1683.
- ↑ O. Takahashi; K. Mikami; T. Nakai. Asymmetric [2,3]-Wittig rearrangement involving a chiral ester enolate terminus. A chiral synthesis of erythro-.ALPHA.-hydroxy-.BETA.-alkyl carboxylic acid derivatives. Chemical Letters. 1987, s. 69. DOI 10.1246/cl.1987.69.
- ↑ M. Uemura; H. Nishimura; T. Minami; Y. Hayashi. (.eta.6-Arene)chromium complexes in organic synthesis: Synthesis of (.+-.)-dihydroxyserrulatic acid. Journal of the American Chemical Society. 1991, s. 5402. DOI 10.1021/ja00014a036.
- ↑ K. Mikami; T. Nakai. Applications of the tandem (2,3)-Wittig-oxy-Cope rearrangement to syntheses of exo-brevicomin and oxocrinol. The scope and limitation of the sigmatropic sequences as a synthetic method for δ,ε-unsaturated ketones. Chemical Letters. 1982, s. 1349–1352. DOI 10.1246/cl.1982.1349.
