Destilace za sníženého tlaku

Destilace za sníženého tlaku, neboli vakuová destilace je druh destilace, který se provádí za nižšího než atmosférického tlaku, což umožňuje přečišťování sloučenin, které nelze snadno destilovat za běžných tlaků, nebo by taková destilace byla příliš pomalá. Používá se, pokud se obtížně dosahuje teploty varu dané sloučeniny, nebo by mohlo dojít k jejímu rozkladu.[1]
Snížení tlaku vyvolá pokles teploty varu. Míru snížení teploty varu lze spočítat podle Clausiovy–Clapeyronovy rovnice.[2]
Využití v laboratořích
[editovat | editovat zdroj]Sloučeniny s teplotami varu do 150 °C se obvykle destilují za běžného tlaku.[3][4][5][6]
Rotační odpařování
[editovat | editovat zdroj]Rotační odpařování se často používá v laboratořích ke koncentrování či izolaci sloučenin. Mnohé sloučeniny jsou těkavé a lze je tak tímto postupem snadno odpařit. Při použití vysokého vakua a zahřátí lze takto odpařit i méně těkavá rozpouštědla. Zjoišťují se tak například množství rozpouštědel v barvách, lacích, a inkoustech.[7]
Průmyslová využití
[editovat | editovat zdroj]
V průmyslu poskytuje vakuová destilace několik výhod.[8]
Směsi, které se nacházejí blízko teploty varu, často k rozdělení vyžadují velký počet rovnovážných stavů. Jejich počet lze snížit vakuovou destilací.[9] Kolony pro vakuovou destilaci v rafinériích ropy mívají obvykle průměry kolem 14 metrů a výšky až 50 metrů, a kapacity převyšující 25 000 krychlových metrů za den.[zdroj?]
Oddělování produktů destilace za sníženého tlaku vylepšuje:
- Zabráněním rozkladů produktů nebo tvorby polymerů, kde nižší tlak snižuje teplotu ve spodní části destilační kolony,
- Výtěžnost a čistotu produktů.
V ropných rafinériích
[editovat | editovat zdroj]Ropa je směsí stovek různých uhlovodíků, většinou obsahujících 3 až 60 atomů uhlíku na molekulu.[10][11][12] Zpracování surové ropy začíná destilací při ptlaku mírně vyšším, než je atmosférický.[8][10][11]
Při destilování by surová ropa neměla být vystavena teplotám nad 370 až 380 °C, kdy se její vysokomolekulární složky rozkládají tepelným krakováním; přitom se vytváří produkty, jež mohou ucpat pec dodávající surový materiál do destilační nádoby.
Z tohoto důvodu se zbytky po první destilaci, obsahující uhlovodíky vroucí za atmosférického tlaku nad 370 °C, dále zpracovávají za nižších tlaků, v rozmezí od 1 do 5 kPa. Tento snížený tlak zvyšuje objem par vytvořených z určitého objemu destilované kapaliny, proto mívají používané kolony velké průměry.[13]
Čištění vody
[editovat | editovat zdroj]Vakuová destilace má využití také při odsolování mořské vody. Mořská voda se umístí do prostoru o nižším tlaku a po dodání tepla se odděluje odsolená voda, jež se následně zkapalňuje. Kondenzování vody brání tomu, aby její páry zaplnily vakuovou komoru, a umožňuje průběžné odstraňování vody bez ztráty podtlaku. Teplo uvolňované kondenzací vodních par se odstraňuje zařízením využívajícím jako chladivo přiváděnou mořskou vodu, kterou tím předehřívá. Některá zařízení nepoužívají chladiče, ale páry stlačují; teplo se tak koncentruje a může být využito u nově dodané vody.[14]
Molekulová destilace
[editovat | editovat zdroj]Molekulová destilace je destilace za tlaků pod 0,01 mmHg (1,3 Pa).[15] Tlak 1 Pa je o řád nižší, než spodní hranice vysokého vakua, kde tekutiny vytvářejí molekulární proudění, kdy jsou střední volné dráhy podobné velikosti zařízení.[1] Plynná fáze nevyvíjí významný tlak na odpařovanou látku, rychlost odpařování tak nezávisí na tlaku, jelikož je přesun hmoty řízen molekulovou dynamikou namísto dynamiky tekutin. Z tohoto důvodu je potřeba, aby vzdálenost mezi horkým a chladným povrchem byla malá, čehož se obvykle dosahuje roptýlením horkého povrchu pokrytého tenkou vrstvou zpracovávaného materiálu blízko chladného povrchu.[zdroj?]
V průmyslu se molekulovou destilací přečišťují oleje.[14]
Obrázky
[editovat | editovat zdroj]-
Zařízení pro krátkodráhovou vakuovou destilaci
-
Perkinův trojúhelník – určený pro destilaci látek citlivých na přítomnost vzduchu
-
Souprava na vakuovou destilaci
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Vacuum distillation na anglické Wikipedii.
- ↑ a b K. C. D. Hickman. Adventures in vacuum chemistry. American Scientist. 2021, s. 231. Dostupné online.
- ↑ Pressure-Temperature Nomograph Interactive Tool [online]. Sigma-Aldrich [cit. 2018-03-23]. Dostupné online.
- ↑ Introduction to Organic Laboratory Techniques: A Small Scale Approach By Donald L. Pavia, Gary M. Lampman, George S. Kriz, Randall G. Engel. Chapter 16
- ↑ J. Leonard; B. Lygo; Garry Procter. Advanced practical organic chemistry. Boca Raton: [s.n.], 2013. ISBN 9781439860977.
- ↑ Nicholas J. Fastuca; Alice R. Wong; Victor W. Mak; Sarah E. Reisman. Asymmetric Michael Addition of Dimethyl Malonate to 2 Cyclopenten-1-one Catalyzed by a Heterobimetallic Complex. Organic Syntheses. 2020, s. 327–338. DOI 10.15227/orgsyn.097.0327. PMID 35614904.
- ↑ Samuel G. Bartko; James Deng; Rick L. Danheiser. Synthesis of 1-Iodopropyne. Organic Syntheses. 2016, s. 245–262. DOI 10.15227/orgsyn.093.0245.
- ↑ [1] Archivováno 8. 11. 2010 na Wayback Machine. SCAQMD Test method 302-91
- ↑ a b Henry Z. Kister. Distillation Design. [s.l.]: McGraw-Hill, 1992. ISBN 0-07-034909-6.
- ↑ Karl Kolmetz, Andrew W. Sloley et al. (2004), Designing Distillation Columns for Vacuum Service, 11th India Oil and Gas Symposium and International Exhibition, September 2004, Mumbai, India
- ↑ a b J. H. Gary; G. E. Handwerk. Petroleum Refining Technology and Economics. [s.l.]: Marcel Dekker, 1984. Dostupné online. ISBN 0-8247-7150-8.
- ↑ a b W. L. Leffler. Petroleum refining for the nontechnical person. [s.l.]: PennWell Books, 1985. Dostupné online. ISBN 0-87814-280-0.
- ↑ James G. Speight. The Chemistry and Technology of Petroleum. [s.l.]: CRC Press, 2006.
- ↑ Karl Kolmetz, Andrew W. Sloley et al (2004), Designing Distillation Columns for Vacuum Service, 11th India Oil and Gas Symposium and International Exhibition, September 2004, Mumbai, India
- ↑ a b Desalination and Water Treatment, Murat Eyvaz, Ebubekir Yüksel 1988/2018. Chapter 5
- ↑ Vogel's 5th ed.
- ↑ HICKMAN, K. C. D. Adventures in vacuum chemistry. American Scientist. Scientific american, 1945, s. xxx–231. Dostupné online [cit. 2021-09-01]. JSTOR 27826079. (anglicky)
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu destilace za sníženého tlaku na Wikimedia Commons
Obrázky, zvuky či videa k tématu destilace za sníženého tlaku na Wikimedia Commons

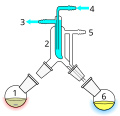
![Kugelrohr – zařízení pro krátkodráhovou destilaci[16]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/82/Kugelrohr_-_numbered.jpg/120px-Kugelrohr_-_numbered.jpg)