Izomerizace
Izomerizace je chemická reakce, při které se molekula, ion nebo fragment molekuly přemění na izomer s jinou strukturou.[1] K takovým reakcím patří mimo jiné enolizace a tautomerizace.[2]
Pokud izomerizace probíhá v rámci jedné molekuly, pak se jedná o přesmyk.
Jestliže je aktivační energie izomerizace dostatečně nízká, tak oba izomery vytvářejí rovnováhu, která je závislá na teplotě. Bylo spočítáno mnoho hodnot standardní volné energie, , pro různé izomerizace, které jsou v souladu s pozorováními.[3]
Příklady a využití
Alkany
K izomerizaci alkanů dochází při krakování ropy. Kromě snížení průměrné délky uhlovodíkových řetězců se také nerozvětvené uhlovodíky přeměňují na rozvětvené izomery:
Paliva obsahující rozvětvené uhlovodíky jsou pro spalovací motory vhodnější, protože mají vyšší oktanové číslo.[4]
Alkeny
Koncové alkeny se izomerují na vnitřní za přítomnosti kovových katalyzátorů při metatezi alkenů.
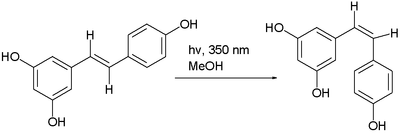
Trans-izomer resveratrolu lze přeměnit na cis-izomer pomocí fotochemické reakce.[5]
Byl popsán tepelný přesmyk azulenu na naftalen.
Ostatní případy
Lobry de Bruynova–Van Ekensteinova transformace je izomerizace sacharidů, kdy se aldóza mění na příslušnou ketózu nebo naopak.
Příkladem organokovové izomerizace je příprava dekafenylferrocenu, [(η5-C5Ph5)2Fe] z jeho vazebného izomeru.[6][7]
Odkazy
Reference
- ↑ Šablona:GoldBookRef
- ↑ L. Antonov. _Concepts and Applications in Science and Technology. Weinheim: Wiley-VCH, 2016. ISBN 978-3-527-33995-2.
- ↑ How to Compute Isomerization Energies of Organic Molecules with Quantum Chemical Methods Stefan Grimme, Marc Steinmetz, and Martin Korth J. Org. Chem.; 2007; 72(6) pp 2118 - 2126; (Article) DOI:10.1021/jo062446p
- ↑ Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2002. DOI 10.1002/14356007.a13_227. Kapitola Hydrocarbons.
- ↑ Resveratrol Photoisomerization: An Integrative Guided-Inquiry Experiment Elyse Bernard, Philip Britz-McKibbin, Nicholas Gernigon Vol. 84 No. 7 July 2007 Journal of Chemical Education 1159.
- ↑ K. N. Brown; L. D. Field; P. A. Lay; C. Lindall; A. F. Masters. (η5-Pentaphenylcyclopentadienyl){1-(η6-phenyl)-2,3,4,5-tetraphenylcyclopentadienyl}iron(II), [Fe(η5-C5Ph5){(η6-C6H5)C5Ph4}], a linkage isomer of decaphenylferrocene. J. Chem. Soc., Chem. Commun.. 1990, s. 408–410. DOI 10.1039/C39900000408.
- ↑ L. D. Field, T. W. Hambley, P. A. Humphrey, C. M. Lindall, G. J. Gainsford, A. F. Masters, T. G. Stpierre, J. Webb. Decaphenylferrocene. Aust. J. Chem.. 1995, s. 851–860. DOI 10.1071/CH9950851.