Ramachandranův diagram
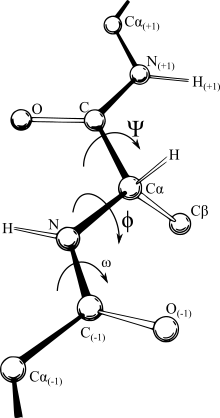


Ramachandranův diagram zobrazuje všechny kombinace torzních úhlů (úhel mezi dvěma rovinami) phí a psi, které jsou v peptidovém řetězci možné. Úhel φ (phí) reprezentuje rotaci kolem vazby atomů N1 a Cα, úhel ψ (psi) reprezentuje rotaci kolem vazby Cα a C1. Dalším důležitým úhlem je úhel ω, který reprezentuje rotaci kolem vazby C0 a N1, tedy samotné peptidické vazby. Vzhledem k charakteru této vazby, který je podobný vazbě dvojné, však nedochází k její rotaci.
Ze všech teoreticky možných kombinací vazebných úhlů φ a ψ jich však ve skutečných proteinech pozorujeme pouze zlomek. To je dáno van der Waalsovskými vzdálenostmi (poloměry) atomů, které udávají nejbližší možnou vzdálenost, na kterou se mohou atomy přiblížit. Řada teoreticky možných kombinací vazebných úhlů φ a ψ by v reálu vedla k tomu, že by se k sobě atomy peptidu (nejčastěji jeho postranního řetězce) přibližovaly více, než umožňují jejich van der Waalsovské vzdálenosti a docházelo by ke srážkám. Struktura by byla nestabilní, je zde sterická zábrana. [1]
Kombinace vazebných úhlů φ a ψ, můžeme rozdělit podle zvoleného dělení do několika skupin:
- přednostně zaujímané
- povolené
- výjimečně povolené
- zakázané
Rozložení těchto skupin je pro většinu peptidů stejné, výjimky tvoří glycin a prolin. Pro glycin se, tím že má postranní skupinu nahrazenu atomem vodíku, značně zvyšuje plocha povolených skupin v grafu a tím i jeho flexibilita. Pro prolin se kvůli přítomnosti cyklické postranní skupiny napojené na hlavní řetězec značně snižuje počet povolených kombinací úhlů φ a ψ, které by nevedly ke srážce atomů, tím se jeho flexibilita naopak silně zmenšuje. U ostatních aminokyselin nejde ani tak o složení a délku postranního řetězce, ale spíš o přítomnost Cβ, který u nich nejvíce ovlivňuje počet povolených kombinací úhlů φ a ψ. Přednostně zaujímané kombinace vazebných úhlů odpovídají hodnotám reálných tvarů, tvořených aminokyselinami v peptidovém řetězci – tj. pravotočivým helixům a beta listům.[2]
Ramachandranův diagram je využíván pro ověření kvality strukturních modelů, získaných ať už rentgenovou difrakcí krystalů proteinu, nebo například na základě homologního modelování. Žádná z aminokyselin v modelovaném řetězci by neměla mít zakázané kombinace vazebných úhlů. Jsou-li takové kombinace přítomny, model není v daném úseku zcela věrohodný. Spolehlivé on-line a free dostupné možnosti pro zobrazení a tvorbu Ramachandrova diagramu představují např. tyto stránky a software:
- Swiss-PdbViewer Archivováno 1. 12. 2009 na Wayback Machine.
- PROCHECK
- Ramachandran plot 2.0 Archivováno 15. 11. 2013 na Wayback Machine.
Reference[editovat | editovat zdroj]
- ↑ Ramachandran, G.N.; Ramakrishnan, C.; Sasisekharan, V. (1963). "Stereochemistry of polypeptide chain configurations". Journal of Molecular Biology 7: 95–9. doi:10.1016/S0022-2836(63)80023-6. PMID 13990617
- ↑ VOET, Donald; VOET, Judith. Biochemistry. 4. vyd. [s.l.] : Wiley, 2010. ISBN 978-0470-57095-1.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Ramachandranův diagram na Wikimedia Commons
Obrázky, zvuky či videa k tématu Ramachandranův diagram na Wikimedia Commons
