Peptidová deformyláza
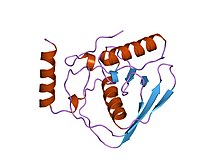
Peptidová deformyláza je enzym, který odstraňuje formylovou skupinu z N-terminu vznikajících polypeptidových řetězců v eubakteriích, mitochondriích a chloroplastech.[1]
Peptidové deformylázy jsou metaloenzymy což znamená, že na sebe vážou kovový kofaktor, typicky Fe2+ nebo Zn2+.[2]
Existují dva typy peptidových deformyláz, typ I a II, které se liší strukturou především na vnějším povrchu .
Funkce
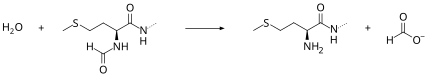
[editovat | editovat zdroj]Peptidová deformyláza odstraňuje formylovou skupinu z N-terminu vznikajících polypeptidů, přímo nebo hned poté co jsou syntetizovány ribozomem. Funkci peptidové deformylázy lze popsat následující rovnicí, kde formyl-L-methionylpeptid a voda reagují za vzniku formiátu a methionylpeptidu:
- H2O + formyl-L-methionylpeptid methionylpeptid + formiát
Tato reakce probíhá přímo na povrchu ribozomu, kde C-terminální alfa-helix peptidové deformylázy interaguje s ribozomálními proteiny uL22 a bL32 a rRNA.[3]
Pro svou funkci patří tento enzym do rodiny hydroláz. Systematický název této třídy enzymů je proto formyl-L-methionylpeptid amidohydroláza.
Strukturální studie
[editovat | editovat zdroj]Ke konci roku 2007 bylo pro tuto třídu enzymů nalezeno 34 struktur s přístupovými kódy PDB 1IX1, 1LM4, 1LM6, 1LME, 1LQW, 1LQY 1SZZ 1LRU, 1LRY, 1N5N, 1Q1Y, 1SV2, 1S17 1V3Y 1VEV 1VEY, 1VEZ, 1WS0, 1WS1, 1XEM, 1XEN, 1XEO, 1Y6H, 1ZXZ 2EW6 1ZY0, 1ZY1, 2AI7, 2AI8, 2AI9, 2AIA, 2AIE, 2EW5, 2EW7
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Peptide deformylase na anglické Wikipedii.
- ↑ Escobar-Alvarez S, Goldgur Y, Yang G, Ouerfelli O, Li Y, Scheinberg DA. Structure and activity of human mitochondrial peptide deformylase, a novel cancer target. Journal of Molecular Biology. April 2009, s. 1211–1228. DOI 10.1016/j.jmb.2009.02.032. PMID 19236878.
- ↑ Becker A, Schlichting I, Kabsch W, Schultz S, Wagner AF. Structure of peptide deformylase and identification of the substrate binding site. The Journal of Biological Chemistry. May 1998, s. 11413–11416. DOI 10.1074/jbc.273.19.11413. PMID 9565550.
- ↑ McGrath H, Černeková M, Kolář MH. Binding of the peptide deformylase on the ribosome surface modulates the exit tunnel interior. Biophysical Journal. December 2022, s. 4443–4451. DOI 10.1016/j.bpj.2022.11.004. PMID 36335428. Bibcode 2022BpJ...121.4443M.

