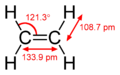Wikipedistka:Naďa Čel/Pískoviště
Slavní organičtí chemici - ACS Divize organické chemie (organicdivision.org)
Seznam chemiků – Wikipedie (wikipedia.org)
Jednoduchá vazba je forma kovalentní vazby, která obsahuje dva vazebné elektrony, které spojují dva atomy. Vazby se účastní dva valenční elektrony a vytvářejí elektronový pár, které pak atomy sdílejí. Jednoduchá vazba se zapisuje pomocí Lewisova vzorce A:A nebo A-A, kde A jsou atomy vázaných prvků. V prvním případě každá tečka představuje jeden sdílený elektron a v druhém čárka označuje sdílený pár elektronů.[1]
Jednoduchá vazba je obvykle typu sigma. Kromě jednoduché vazby, existuje i dvojná a trojná vazba (dvojná vazba se skládá z jedné vazby sigma a jedné vazby pí a trojná z jedné vazby sigma a dvou vazeb pí). Tyto vazby mají obecně vyšší energii a menší délku než vazba jednoduchá. Jednoduchá vazba je z nich tedy nejslabší. Vícenásobné vazby jsou spíše výjimečné.
Princip jednoduché vazby[editovat | editovat zdroj]

Princip jednoduché vazby se dá jednoduše vysvětlit pomocí hybridizace orbitalů, což je proces energetického sjednocení původně energeticky nerovnocenných atomových orbitalů. Například u atomu uhlíku, který má čtyři valenční elektrony umístěné v orbitalech 2s a 2p, může dojít ke třem typům hybridizace:
- sp3 - jednoduchá tetraedrická (trojboký jehlan) vazba v alkanech
Hybridizace sp3 u jednoduché vazby znamená, že jeden orbital typu 2s s kulovou symetrií a tři orbitaly typu 2p s lineární symetrií, vzájemně k sobě kolmé, vytvoří čtyři nové identické hybridizované orbitaly označované jako sp3. Aby mohly být identické, nemohou být již na sebe kolmé, ale jejich osy musí mít symetrii pravidelného čtyřstěnu (tetraedru), ve kterém atom uhlíku leží v těžišti tohoto tělesa. Osy orbitalů proto vzájemně svírají úhel 109,47°.
V případě překryvu orbitalů uhlíkových atomů vzniká σ-vazba C-C, jejíž průměrná délka v alkanech je 154 pm (1,54×10−10 m). Mezi atomy C-H vzniká σ-vazba, která je kratší a měří kolem 109 pm (1,09×10−10 m).
Izomerie[editovat | editovat zdroj]
Jednoduchá vazba má schopnost rotace, což je vlastnost, kterou nemá dvojná vazba nebo trojná vazba. Sigma vazba není tak omezující a jednoduchá vazba je schopna rotovat pomocí sigma vazby jako osy rotace
Části molekul mohou kolem jednoduché vazby rotovat, vlivem čehož dochází k specifickému druhu izomerie. Vznikají takzvané konformery. To u násobných vazeb není možné.
Příklady sloučenin[editovat | editovat zdroj]
Nejčastější podobou je jednoduchá vazba, tvořená dvojicí elektronů, jedním z každého atomu. Jednoduchá vazba uhlík–uhlík je druhu sigma a vzniká překryvem jednoho hybridizovaného orbitalu z každého atomu. V molekule ethanu jde o sp3-
Uhlík je jedním z mála prvků, které mohou tvořit dlouhé řetězce svých vlastních atomů, tato vlastnost se nazývá katenace a je způsobena vysokými energiemi vazeb uhlík–uhlík, což umožňuje vytvářet obrovské množství uspořádání molekul; mnohé z nich jsou obsaženy v živých organismech, sloučeniny uhlíku tak mají vlastní chemické odvětví: organickou chemii.
C-C řetězce jsou často rozvětvené. Uhlíkové atomy lze podle počtu dalších uhlíků na ně navázaných rozdělit takto:
- Na primární uhlík je navázán jeden další.
- Na sekundární se připojují dva.
- Terciární uhlík má na sebe připojené tři další uhlíky.
- Na kvartérní uhlíky jsou navázány čtyři jiné atomy uhlíku.
V „organických molekulách se složitou strukturou“ se vyskytují trojrozměrně uspořádané vazby uhlík–uhlík na kvartérních místech, které určují tvary molekul. Tato kvartérní místa se nacházejí v řadě biologicky aktivních malých molekulách, jako jsou kortizon a morfin.
Vazba uhlík-vodík (C–H) je kovalentní vazba mezi atomy uhlíku a vodíku; vyskytuje se v mnoha organických sloučeninách. Jeden uhlík může sdílet své valenční elektrony až se čtyřmi atomy vodíku, čímž atomy dosáhnou elektronové konfigurace vzácného plynu. Obvyklé délky těchto vazeb jsou okolo 109 pm (1,09 × 10−10 m) a vazebné energie kolem 413 kJ/mol (viz tabulku níže). Vzhledem k tomu, že elektronegativita má u C hodnotu 2,55 a u H 2,2, tak se vazby C−H v důsledku malých rozdílů elektronegativity mezi vázanými atomy obvykle považují za nepolární. Ve strukturních vzorcích organických sloučenin se atomy vodíku často nezobrazují. Ke sloučeninám obsahujícím pouze vazby C–H a C–C patří alkany, alkeny, alkyny a areny, sloučeniny souhrnně označované jako uhlovodíky.
Jednoduché vazby se často vyskytují v dvouatomových molekulách jako jsou například H2, F2 a H-Cl; také ve víceatomových molekulách (alkany, H2O).
Jednoduché vazby C-C jsou slabší než vazby C-H, O-H, N-H, H-H, H-Cl, C-F a řada dvojných či trojných vazeb, a podobně silné jako C-O, Si-O, P-O a S-H, většinou jsou však považovány za silné.
| Vazba C–C | Molekula | Disociační energie vazby (kJ/mol) |
|---|---|---|
| CH3–CH3 | ethan | 380 |
| C6H5–CH3 | toluen | 430 |
| C6H5–C6H5 | bifenyl | 480 |
| CH3C(O)–CH3 | aceton | 350 |
| CH3–CN | acetonitril | 570 |
| CH3–CH2OH | ethanol | 370 |
Výše uvedené hodnoty patří k obvyklým pro vazby C-C; ojediněle se mohou objevit hodnoty výrazně mimo toto rozmezí.
Dvojná vazba je forma kovalentní vazby, která obsahuje čtyři vazebné elektrony. Tyto elektrony tvoří dva elektronové páry, které pak spojují dva atomy. Dvojné vazby jsou bohaté na elektrony, proto jsou reaktivní. zvláště v přítomnosti silného akceptoru elektronů (například halogenů). Ve strukturních vzorcích se dvojná vazba znázorňuje dvěma rovnoběžnými čarami mezi atomy.[1]
Mezi stejnými dvěma atomy je dvojná vazba obecně silnější a kratší než vazba jednoduchá. Pokud molekula obsahuje dvě nebo více dvojných vazeb, jsou označovány podle polohy jako kumulované, konjugované nebo izolované.
Nejčastější dvojnou vazbou je vazba mezi dvěma atomy uhlíku v alkenech. Existuje ale i mezi dalšími prvky. Například v karbonylové skupině mezi atomem uhlíku a atomem kyslíku (C=O), v azosloučeninách (N=N), iminech (C=N) a sulfoxidech (S=O).
Historie[editovat | editovat zdroj]
- Dvojné vazby zavedl v chemické terminologii ruský chemik Alexander Michajlovič Butlerov (1828-1886).
- Reprezentaci dvojné vazby dvěma dvojnými čarami zavedl rakouský chemik a fyzik Johann Josef Loschmidt (1821-1895).
- Koncovky -an, -en, -in pro označení nasycených (jednoduchá vazba) a nenasycených alkanů (dvojná a trojná vazba) zavedl německý chemik August Wilhelm von Hofmann (1818-1892).
Princip dvojné vazby[editovat | editovat zdroj]

Princip dvojné vazby se dá jednoduše vysvětlit pomocí hybridizace orbitalů, což je proces energetického sjednocení původně energeticky nerovnocenných atomových orbitalů. Například u atomu uhlíku, který má čtyři valenční elektrony umístěné v orbitalech 2s a 2p, může dojít ke třem typům hybridizace:
- sp - jednoduchá lineární vazba v alkanech
- sp2 - dvojná trigonální (trojúhelníková) vazba v alkenech
- sp3 - trojná tetraedrické (trojboký jehlan) vazba v alkynech
Například v ethenu CH2=CH2 má každý atom uhlíku tři hybridizované orbitaly sp2 (leží v jedné rovině s uhly 120° mezi nimi) a jeden nehybridizivaný orbital pz (leží kolmo k této rovině). Když se tyto dva atomy uhlíku přiblíží, jeden ze tří orbitalů sp2 na prvním uhlíku vytvoří σ vazbu s příslušným orbitalem sp2 na druhém uhlíku. Ve stejnou chvíli spolu orbitaly pz obou uhlíků vytvoří π vazbu. Tak mezi nimi vznikne dvojná vazba.
-
Dva sp2 se přiblíží a vytvoří σ vazbu, která leží v rovině.
-
Dva pz orbitaly se překryjí a vytvoří π vazbu v rovině rovnoběžné se σ vazbou
Vlastnosti dvojné vazby[editovat | editovat zdroj]

Mají-li molekuly s dvojnou vazbou dva různé substituenty, rozlišuje se mezi cis- a trans-izomery podle jejich polohy k dvojné vazbě. Důvodem je maximální překryv orbitalů pz, které jsou kolmé k hybridizovaným orbitalům sp2, a proto není možná rotace kolem dvojné vazby.
Pokud má sloučenina více dvojných vazeb, dělí se podle své polohy na:
- kumulativní vazby - jsou přímo sousedící
- konjugované vazby - jsou oddělené právě jednou jednoduchou vazbou
- izolované vazby - jsou oddělené více než jednou jednoduchou vazbou
Příklady sloučenin[editovat | editovat zdroj]

Odkazy[editovat | editovat zdroj]
Související články[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byly použity překlady textů z článků Double bond na anglické Wikipedii a Doppelbindung na německé Wikipedii.