Chlorid měďnatý
| Chlorid měďnatý | |
|---|---|
 Bezvodý chlorid měďnatý | |
 Dihydrát chloridu měďnatého | |
| Obecné | |
| Systematický název | chlorid měďnatý |
| Latinský název | Cupri chloridum Cuprum chloratum |
| Anglický název | Copper(II) chloride |
| Německý název | Kupfer(II)-chlorid |
| Sumární vzorec | CuCl2 |
| Vzhled | žlutohnědá práškovitá látka modrozelená krystalická látka (dihydrát) |
| Identifikace | |
| Registrační číslo CAS | 7447-39-4 10125-13-0 (dihydrát) |
| PubChem | 169664 |
| SMILES | Cl[Cu]Cl |
| InChI | 1S/2ClH.Cu/h2*1H;/q;;+2/p-2 |
| Číslo RTECS | GL7000000 |
| Vlastnosti | |
| Molární hmotnost | 134,452 g/mol 170,483 g/mol (dihydrát) |
| Teplota tání | 620 °C 110 °C (dehydratace dihydrátu) |
| Teplota rozkladu | 993 °C |
| Hustota | 3,386 g/cm3 2,51 g/cm3 (dihydrát) |
| Index lomu | nD= 1,684 (dihydrát) |
| Rozpustnost ve vodě | 69,2 g/100 g (0 °C) 71,5 g/100 g (10 °C) 74,5 g/100 g (20 °C) 76,4 g/100 g (25 °C) 78,3 g/100 g (30 °C) 81,8 g/100 g (40 °C) 85,5 g/100 g (50 °C) 89,4 g/100 g (60 °C) 98,0 g/100 g (80 °C) 110,5 g/100 g (100 °C) dihydrát 110,27 g/100 g (0 °C) 117,58 g/100 g (20 °C) 149,39 g/100 g (60 °C) 201,67 g/100 g (100 °C) |
| Rozpustnost v polárních rozpouštědlech | methanol 56,5 g/100 g (0 °C) 58,6 g/100 g (20 °C) 61,8 g/100 g (40 °C) 66,4 g/100 g (60 °C) ethanol 43,3 g/100 g (0 °C) 50,0 g/100 g (20 °C) 58,3 g/100 g (40 °C) 70,8 g/100 g (60 °C) kyselina octová glycerol aceton diethylether |
| Rozpustnost v nepolárních rozpouštědlech | pyridin |
| Součinitel tepelné vodivosti | 0,544 3 Wm−1K−1 (15 °C) |
| Měrná magnetická susceptibilita | 116,99×10−6 cm3g−1 (17 °C) 104,93×10−6 cm3g−1 (17 °C, dihydrát) |
| Struktura | |
| Krystalová struktura | bazálně centrovaná jednoklonná kosočtverečná (dihydrát) |
| Hrana krystalové mřížky | a= 685 pm b= 330 pm c= 670 pm β=121° dihydrát a= 738 pm b= 804 pm c= 372 pm |
| Koordinační geometrie | osmistěnná |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −215,8 kJ/mol −818,6 kJ/mol (dihydrát) |
| Entalpie rozpouštění ΔHrozp | −385 J/g |
| Standardní molární entropie S° | 108 JK−1mol−1 190,6 JK−1mol−1(dihydrát) |
| Standardní slučovací Gibbsova energie ΔGf° | −171,4 kJ/mol −660,8 kJ/mol (dihydrát) |
| Izobarické měrné teplo cp | 0,534 6JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R22, R36/38, R50/53 |
| S-věty | S22, S26, S61 |
| NFPA 704 |  0
2
1
|
Některá data mohou pocházet z datové položky. | |
Chlorid měďnatý je anorganická sloučenina se vzorcem CuCl2. Jedná se o žlutohnědou tuhou látku, která pomalu pohlcuje vlhkost a tvoří modrozelený dihydrát. Chlorid měďnatý je druhou nejrozšířenější měďnatou sloučeninou po síranu měďnatém.
Struktura[editovat | editovat zdroj]
Bezvodý chlorid měďnatý má strukturu vycházející z té, kterou známe od jodidu kademnatého. Měďnatá centra jsou osmistěnná. Většina měďnatých sloučenin vykazuje deformace oproti ideální osmistěnné geometrii vlivem Jahn-Tellerova efektu, který zde popisuje lokalizaci jednoho elektronu d v orbitalu, kde je silně antivazebný oproti páru chloridových ligandů. V CuCl2·2H2O má měď opět silně zdeformovanou osmistěnnou geometrii, centra mědi jsou obklopena dvěma ligandy vody a čtyřmi chloridovými, které asymetricky přemosťují měďnatá centra.[2]
Chlorid měďnatý je paramagnetický. V historii byl CuCl2·2H2O použit pro první měření paramagnetické rezonance elektronů, a to Jevgenijem Zavojským v roce 1944.[3][4]
Vlastnosti a reakce[editovat | editovat zdroj]
Vodné roztoky připravované z chloridu měďnatého obsahují škálu měďnatých komplexů v závislosti na koncentraci, teplotě a přítomnosti dalších chloridových iontů. Tato škála sahá od modré barvy [Cu(H2O)6]2+ až po žlutou nebo červenou barvu halogenidových komplexů se vzorcem [CuCl2+x]x−.[5]

Při 1 000 °C se chlorid měďnatý rozkládá na chlorid měďný a chlor:
- 2 CuCl2 → 2 CuCl + Cl2
S chlorovodíkem nebo jinými zdroji chloridu tvoří komplexní ionty: červený CuCl3− nebo žlutý CuCl42−.[6]
- CuCl2 + 2 Cl− ⇌ CuCl3− + Cl− ⇌ CuCl42−
Některé z těchto komplexů mohou krystalizovat z vodných roztoků a získávají širokou škálu různých struktur.
Při přidání hydroxidu do roztoku chloridu měďnatého se sráží hydroxid měďnatý:
- CuCl2 + 2 NaOH → Cu(OH)2 + 2 NaCl
Chlorid měďnatý tvoří také různé koordinační komplexy s ligandy, například s pyridinem nebo trifenylfosfanoxidem:
- CuCl2 + 2 C5H5N → [CuCl2(C5H5N)2] (čtyřstěnný)
- CuCl2 + 2 (C6H5)3P=O → [CuCl2((C6H5)3P=O)2] (čtyřstěnný)
Ovšem některé „měkké ligandy“, například fosfanové (kupř. trifenylfosfan), jodidové nebo kyanidové, stejně jako třeba některé terciární aminy, způsobují redukci na měďné komplexy. Pro převod chloridu měďnatého na měďné deriváty je ale obecně běžnější redukovat vodný roztok oxidem siřičitým:
- 2 CuCl2 + SO2 + 2 H2O → 2 CuCl + 2 HCl + H2SO4
Hydrolýzou chloridu měďnatého vzniká oxychlorid měďnatý, Cu2Cl(OH)3, populární fungicid.
Příprava[editovat | editovat zdroj]
Chlorid měďnatý se komerčně připravuje chlorací mědi:
- Cu + Cl2 + 2 H2O → CuCl2 · 2 H2O
Lze ho vyrábět také z hydroxidu, oxidu nebo uhličitanu měďnatého působením kyseliny chlorovodíkové. Elektrolýzou vodného roztoku chloridu sodného s měděnými elektrodami vzniká (kromě jiného) modrozelená pěna, kterou lze sbírat a převádět na hydrát chloridu měďnatého.
Bezvodý CuCl2 lze připravovat přímo slučováním prvků, tedy mědi a chloru.
CuCl2 lze čistit krystalizací z horké zředěné kyseliny chlorovodíkové, ochlazováním v lázni chloridu vápenatého a ledu.[7][8]
Výskyt v přírodě[editovat | editovat zdroj]
Chlorid měďnatý se v přírodě vyskytuje jako velmi vzácný nerost tolbachit a v podobě dihydrátu jako eriochalcit. Oba se objevují blízko fumarol. Rozšířenější jsou smíšené oxyhydroxid-chloridy, například atacamit Cu2(OH)3Cl, objevující se v oxidačních zónách slojí měděné rudy za suchého podnebí (též v některých pozměněných usazeninách).
Použití[editovat | editovat zdroj]
Kokatalyzátor ve Wackerově procesu[editovat | editovat zdroj]
Hlavní průmyslovou aplikací chloridu měďnatého je jako kokatalyzátor (společně s chloridem palladnatým) ve Wackerově procesu. Zde se ethen (ethylen) převádí na ethanal (acetaldehyd) pomocí vody a vzduchu. Při reakci se PdCl2 redukuje na elementární palladium, CuCl2 ho oxiduje zpět na PdCl2. Vzduch pak oxiduje výsledný chlorid měďný zpět na chlorid měďnatý, čímž se cyklus uzavře.
- C2H4 + PdCl2 + H2O → CH3CHO + Pd + 2 HCl
- Pd + 2 CuCl2 → 2 CuCl + PdCl2
- 4 CuCl + 4 HCl + O2 → 4 CuCl2 + 2 H2O
Celý proces lze zapsat takto:
- 2 C2H4 + O2 → 2 CH3CHO
Chlorace[editovat | editovat zdroj]
Chlorid měďnatý katalyzuje chloraci při výrobě vinylchloridu a dichlorethanu.[9]
Další aplikace v organické syntéze[editovat | editovat zdroj]
Chlorid měďnatý má řadu různých specializovaných aplikací v syntéze organických sloučenin.[7] Chloruje aromatické uhlovodíky – často za přítomnosti oxidu hlinitého. Je schopen chlorovat alfapozici karbonylových sloučenin:[10]
Tato reakce probíhá v polárních rozpouštědlech, například dimethylformamidu (DMF), často v přítomnosti chloridu lithného, který reakci urychluje.
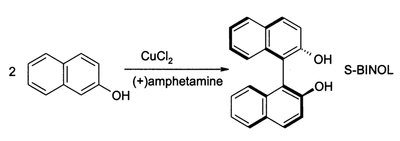
Za přítomnosti kyslíku může CuCl2 oxidovat fenoly. Takto lze získávat chinon nebo spřažený produkt oxidativní dimerizace. Druhý z procesů poskytuje (s velkou výtěžností) 1,1-binaftol:[11]
Takové sloučeniny jsou surovinami pro syntézu BINAP a jeho derivátů.
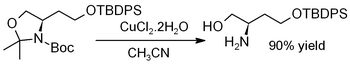
Dihydrát chloridu měďnatého vyvolává hydrolýzu acetonidů, tj. deprotekci k regeneraci diolů[12] nebo aminoalkoholů, jako v tomto příkladě (kde TBDPS = terc-butyldifenylsilyl):[13]
Pyrotechnika[editovat | editovat zdroj]
CuCl2 lze použít v pyrotechnice k barvení plamene na modrozeleno (podobně jako další sloučeniny mědi).
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Copper(II) chloride na anglické Wikipedii.
- ↑ a b Cupric chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ Peter Baláž. Mechanochemistry in Nanoscience and Minerals Engineering. [s.l.]: Springer, 2008. Dostupné online. ISBN 3540748547. S. 167.
- ↑ Marina Brustolon. Electron paramagnetic resonance: a practitioner's toolkit. [s.l.]: John Wiley and Sons, 2009. Dostupné online. ISBN 0470258829. S. 3.
- ↑ Greenwood, N. N. and Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ↑ Naida S. Gill et al.. Inorganic Syntheses. Inorg. Synth.. 1967, s. 136–142. ISBN 9780470132401. DOI 10.1002/9780470132401.ch37.
- ↑ a b S. H. Bertz, E. H. Fairchild, in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 220-3, Wiley, New York, 1999.
- ↑ W. L. F. Armarego, Christina Li Lin Chai. Purification of Laboratory Chemicals. 6th. vyd. [s.l.]: Butterworth-Heinemann, 2009-05-22. Dostupné online. ISBN 1856175677. S. 461.
- ↑ H.Wayne Richardson, "Copper Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim, DOI:10.1002/14356007.a07_567
- ↑ C. E. Castro, E. J. Gaughan, D. C. Owsley. Cupric Halide Halogenations. Journal of Organic Chemistry. 1965, s. 587. DOI 10.1021/jo01013a069.
- ↑ J. Brussee, J. L. G. Groenendijk, J. M. Koppele, A. C. A. Jansen. On the mechanism of the formation of s(−)-(1, 1'-binaphthalene)-2,2'-diol via copper(II)amine complexes. Tetrahedron. 1985, s. 3313. DOI 10.1016/S0040-4020(01)96682-7.
- ↑ CHANDRASEKHAR, M., Kusum L. Chandra, and Vinod K. Singh. Total Synthesis of (+)-Boronolide, (+)-Deacetylboronolide, and (+)-Dideacetylboronolide. Journal of Organic Chemistry. 2003, s. 4039–4045. DOI 10.1021/jo0269058. PMID 12737588.
- ↑ KRISHNA, Palakodety Radha, G. Dayaker. A stereoselective total synthesis of (-)-andrachcinidine via an olefin cross-metathesis protocol. Tetrahedron Letters. Elsevier, 2007, s. 7279–7282. DOI 10.1016/j.tetlet.2007.08.053.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu chlorid měďnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid měďnatý na Wikimedia Commons - Copper (II) Chloride – Description and Pictures Archivováno 7. 9. 2015 na Wayback Machine.
Literatura[editovat | editovat zdroj]
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.