Sulfolen
| Sulfolen | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 2,5-dihydro-1H-1λ⁶-thiofen-1,1-dion 2,5-dihydrothiofen-1,1-dioxid |
| Ostatní názvy | butadiensulfon, 3-sulfolen |
| Sumární vzorec | C4H6SO2 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 77-79-2 |
| EC-no (EINECS/ELINCS/NLP) | 201-059-7 |
| PubChem | 6498 |
| SMILES | C1C=CCS1(=O)=O |
| InChI | 1S/C4H6O2S/c5-7(6)3-1-2-4-7/h1-2H,3-4H2 |
| Vlastnosti | |
| Molární hmotnost | 118,15 g/mol |
| Teplota tání | 64,5 °C (337,6 K)[1] |
| Teplota varu | rozkládá se[1] |
| Hustota | 1,3 g/cm3 (15 °C)[1] |
| Rozpustnost ve vodě | rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v toluenu[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H318 H319[1] |
| P-věty | P264 P280 P305+351+338 P310 P337+313 |
| Teplota vzplanutí | 113 °C (386 K)[1] |
Některá data mohou pocházet z datové položky. | |
Sulfolen (také nazývaný butadiensulfon nebo 3-sulfolen) je cyklická organická sloučenina patřící mezi sulfony. Jde o bílou krystalickou pevnou látku rozpustnou ve vodě a mnoha organických rozpouštědlech.[2]
Používá se jako zdroj butadienu.[3]
Příprava[editovat | editovat zdroj]

Sulfolen se připravuje vratnou cheletropní reakcí buta-1,3-dienu s oxidem siřičitým. Sloučeniny se smíchají při teplotě okolo −20 °C za přebytku oxidu siřičitého a přídavku malého množství inhibitoru fenolové polymerizace (například hydrochinonu nebo pyrogallolu) a poté nechá stát několik dnů za pokojové teploty nebo se zahřívá na přibližně 130 °C po 30 minut.[4]
Reakce[editovat | editovat zdroj]
Acidobazické vlastnosti[editovat | editovat zdroj]
Sulfolen nereaguje s kyselinami; lze jej rekrystalizovat z koncentrované HNO3.[5][6]
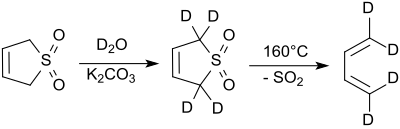
Protony v polohách 2- a 5- mohou být v zásaditém prostředí rychle nahrazeny reakcí s těžkou vodou.[7]
Reakci katalyzuje kyanid sodný.[8]
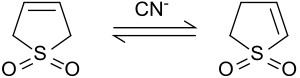
Izomerizace na 2-sulfolen[editovat | editovat zdroj]
V zásaditém prostředí nebo za přítomnosti kyanidových iontů se 3-sulfolen částečně izomerizuje na směs 2-sulfolenu a 3-sulfolenu. Poměr množství obou izomerů závisí na poměru množství kyanidu a sulfolenu.[8]
Při 50 °C rovnovážná směs obsahuje 42 % 3-sulfolenu a 58 % 2-sulfolenu.[9]
Termodynamicky stabilnější 2-sulfolen (s teplotou tání 48 až 49 °C) lze izolovat ze směsi izomerů několikadenním udržováním na teplotě 100 °C, protože 3-sulfolen se rozkládá již nad 80 °C.[10]
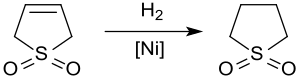
Hydrogenace[editovat | editovat zdroj]
Katalytickou hydrogenací sulfolenu vzniká sulfolan, používaný jako rozpouštědlo v petrochemickém průmyslu při extrakci aromatických sloučenin ze směsí uhlovodíků. Hydrogenace 3-sulfolenu za katalýzy Raneyovým niklem při přibližně 2 MPa a 60 °C mívá výtěžnost nanejvýš 65 %, protože dochází ke snížení účinnosti katalyzátoru působením sloučenin síry.[11]
Halogenace[editovat | editovat zdroj]
3-sulfolen ve vodných roztocích reaguje s bromem za vzniku 3,4-dibromtetrahydrothiofen-1,1-dioxidu, který může být dehydrobromován uhličitanem stříbrným na thiofen-1,1-dioxid.[5] Thiofen-1,1-dioxid lze rovněž připravit z 3,4-bis(dimethylamino)tetrahydrothiofen-1,1-dioxidu dvojitou kvaternizací jodmethanem a Hofmannovou eliminací hydroxidem stříbrným.[10]
Dalším možným postupem je syntéza dehydrobromací 3,4-dibromtetrohydrothiofen-1,1-dioxidu práškovým hydroxidem sodným v tetrahydrofuranu (THF)[12] nebo ultrazvukově rozptýleným draslíkem.[13]
Dielsovy–Alderovy reakce[editovat | editovat zdroj]
3-sulfolen se nejvíce používá k získávání butadienu.[2][3] In situ příprava a okamžité využití buta-1,3-dienu omezuje kontakt s touto látkou, která je za laboratorní teploty plynná. Nevýhodou je, že vytvořený oxid siřičitý může u substrátů citlivých na kyseliny způsobovat vedlejší reakce.
Dielsovy–Alderovy reakce buta-1,3-dienu s málo reaktivními dienofily obvykle vyžadují delší zahřívání nad 100 °C a mohou tak být nebezpečné. Při použití čistého butadienu je potřeba zvláštní vybavení pro práci za vyšších tlaků, použití sulfolenu odstraňuje potřebu stlačeného butadienu, protože vytvořený dien se ihned zapojuje do cykloadice a rovnováha této reakce působí jako bezpečnostní pojistka.[14]
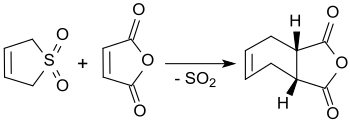
3-sulfolen reaguje s maleinanhydridem ve vroucím xylenu za tvorby anhydridu kyseliny cis-4-cyklohexen-1,2-dikarboxylové s výtěžností až 90 %.[3]
3-sulfolen se rovněž účastní reakcí s dienofily v konfiguraci trans (například diethylfumarátem) při 110 °C za odštěpení SO2 a vzniku diethylesterů kyseliny trans-cyklohex-4-en-1,2-dikarboxylové.[15]
6,7-dibrom-1,4-epoxy-1,4-dihydronaftalen (připravovaný debromací 1,2,4,5-tetrabrombenzenu ekvivalentem n-butyllithia a Dielsovou–Alderovou reakcí ve furanu[16]) reaguje s 3-sulfolenem ve vroucím xylenu, přičemž se tvoří tricyklický adukt. Z této látky také, za použití kyseliny chloristé, vzniká dibromdihydroantracen, který je možné následně dehydrogenovat 2,3-dichlor-5,6-dikyano-1,4-benzochinonem na 2,3-dibromantracen.[17]
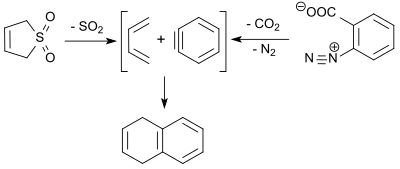
Buta-1,3-dien (vytvořený retrocheletropní reakcí z 3-sulfolenu) reaguje s benzynem (získaným tepelným rozkladem benzendiazonium-2-karboxylátu) v Dielsově–Alderově reakci za vzniku 1,4-dihydronaftalenu.[18]
2- a 3-sulfoleny jako dienofily[editovat | editovat zdroj]
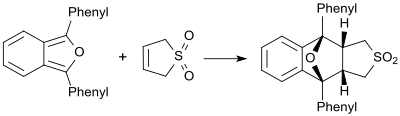
Za přítomnosti velmi reaktivních dienů (například 1,3-difenylisobenzofuranu) se 2- a 3-sulfoleny chovají jako dienofily a vytvářejí příslušné Dielsovy–Alderovy adukty.[19]
V roce 1938 Kurt Alder popsal produkty reakce 2-sulfolenu s buta-1,3-dienem a s cyklopentadienem.[20]
Ostatní cykloadice[editovat | editovat zdroj]
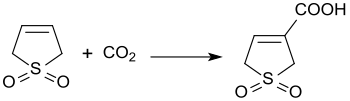
Zásaditě katalyzovanou reakcí 3-sulfolenu s oxidem uhličitým za tlaku 300 kPa vzniká kyselina 3-sulfolen-3-karboxylová s 45% výtěžností.[21]
S diazomethanem vytváří 3-sulfolen 1,3-dipolární cyklický produkt:[22]
Polymerizace[editovat | editovat zdroj]
V roce 1935 zjistil Hermann Staudinger, že reakcí butadienu a SO2 za pokojové teploty vzniká kromě 3-sulfolenu i druhý produkt; jde o amorfní polymer. Radikálovou polymerizací 3-sulfolenu ve směsi diethyletheru a peroxidu vzniká až z 50 % nerozpustný polysulfolen. Tento polymer je odolný vůči rozkladu kyselinou sírovou a dusičnou.[6]
Při následném zkoumání byla iniciována polymerizace 3-sulfolenu při teplotách nad 100 °C za přítomnosti radikálového iniciátoru azobis(isobutyronitrilu) (AIBN).[23]
3-sulfolen nevstupuje do kopolymerizačních reakcí s vinylovými sloučeninami. 2-sulfolen naopak nevytváří homopolymer, ovšem může tvořit kopolymery s vinylovými sloučeninami, jako jsou akrylonitril a vinylacetát.
3-sulfolen jako recyklovatelné rozpouštědlo[editovat | editovat zdroj]
Vratnost přeměny 3-sulfolenu na buta-1,3-dien a oxid siřičitý umožňuje použití sulfolenu jako recyklovatelného aprotického dipolárního rozpouštědla nahrazujícího dimethylsulfoxid (DMSO), jehož separace a opětovné použití jsou obtížné.[24]
Jako model byla zkoumána reakce benzylazidu s nitrilem kyseliny 4-toluensulfonové za vzniku 1-benzyl-5-(4-toluensulfonyl)tetrazolu. Přípravu tetrazolu lze provést i bez izolace benzylazidu, a to s 72% celkovou výtěžností.
Po skončení reakce se 3-sulfolen rozloží za teploty 135 °C a butadien (teplota varu −4,4 °C) a oxid siřičitý (teplota varu −10,1 °C) se uskladní v chladicí nádobě při −76 °C s přebytkem oxidu siřičitého. Po přidání hydrochinonu jako inhibitoru lze získat zpět 3-sulfolen zahřátím na povrchovou teplotu. Je ovšem sporné, zda 3-sulfolen využitelný pouze při teplotách mezi 65 a 100 °C může být i v průmyslu použit jako náhrada DMSO (který se snadno skladuje a není příliš nákladný).
Použití[editovat | editovat zdroj]
Kromě výše popsaného syntetického využití se sulfolen také používá jako přídatná látka při elektrochemických fluoracích. Výtěžnost perfluoroktansulfonylfluoridu může zvýšit na přibližně 70 %.[25]
Sulfolen je dobře rozpustný v kyselině fluorovodíkové a zvyšuje vodivost elektrolytů.[25] Při tomto použití u něj dochází k otevírání kruhu a fluoraci za vzniku sulfonylfluoridu perfluorbutanu.
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Sulfolene na anglické Wikipedii.
- ↑ a b c d e f g h i j k 3-Sulfolene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b J. M. McIntosh. E-EROS Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2001. DOI 10.1002/047084289X.rs130. Kapitola 3-Sulfolene.
- ↑ a b c Thomas E. Sample; Lewis F. Hatch. 3-Sulfolene: A Butadiene Source for a Diels-Alder Synthesis. Journal of Chemical Education. 1968, s. 55. DOI 10.1021/ed045p55.
- ↑ Volume IX: Sulfur, Selenium, Tellurium Compounds. [s.l.]: Georg Thieme Verlag, 1955. ISBN 978-3-13-208104-8. S. 237.
- ↑ a b Šablona:Cite patent
- ↑ a b H. Staudinger; B. Ritzenthaler. Über hochmolekulare Verbindungen, 104. Mitteil.: Über die Anlagerung von Schwefeldioxyd an Äthylen-Derivate. Chemische Berichte. 1935, s. 455–471. DOI 10.1002/cber.19350680317.
- ↑ J. Leonard; A. B. Hague; J. A. Knight. Organosulfur Chemistry. [s.l.]: Academic Press, 1998. ISBN 0-12-543562-2. Kapitola 6. Preparation of substituted 3-sulfolenes and their use as precursors for Diels-Alder dienes, s. 241.
- ↑ a b Šablona:Cite patent
- ↑ C. D. Broaddus. Equilibria and base-catalyzed exchange of substituted olefins. Accounts of Chemical Research. 1968, s. 231–238. DOI 10.1021/ar50008a002.
- ↑ a b W. J. Bailey; E. W. Cummins. Cyclic dienes. III. The synthesis of thiophene-1,1-dioxide. Journal of the American Chemical Society. 1954, s. 1932–1936. DOI 10.1021/ja01636a058.
- ↑ Šablona:Cite patent
- ↑ D. M. Lemal; G. D. Goldman. Synthesis of azulene, a blue hydrocarbon. Journal of Chemical Education. 1988, s. 923. DOI 10.1021/ed065p923.
- ↑ T.-S. Chou; M.-M. Chen. Chemoselective reactions of ultrasonically dispersed potassium with some brominated hydrothiophene-S,S-dioxides. Heterocycles. 1987, s. 2829–2834. DOI 10.3987/R-1987-11-2829.
- ↑ M. A. Filatov, S. Baluschev, I. Z. Ilieva, V. Enkelmann, T. Miteva, K. Landfesterm, S. E. Aleshchenkov, A. V. Cheprakov. Tetraaryltetraanthra[2,3]porphyrins: Synthesis, Structure, and Optical Properties. The Journal of Organic Chemistry. 2012, s. 11119–11131. DOI 10.1021/jo302135q. PMID 23205621.
- ↑ Diethyl trans-Δ4-tetrahydrophthalate. Org. Synth.. DOI 10.15227/orgsyn.050.0043.
- ↑ H. Hart; A. Bashir-Hashemi; J. Luo; M. A. Meador. Iptycenes: Extended Triptycenes. Tetrahedron. 1986, s. 1641–1654. DOI 10.1016/S0040-4020(01)87581-5.
- ↑ C.-T. Lin; T.-C. Chou. Synthesis of 2,3-dibromoanthracene. Synthesis. 1988, s. 628–630. DOI 10.1055/s-1988-27659.
- ↑ L. F. Hatch; D. Peter. Reaction of benzyne with butadiene. Chemical Communications. 1968, s. 1499. DOI 10.1039/C19680001499.
- ↑ M. P. Cava; J. P. VanMeter. Condensed cyclobutane aromatic compounds. XXX. Synthesis of some unusual 2,3-naphthoquinonoid heterocycles. A synthetic route to derivatives of naphtho[2,3-b]biphenylene and anthra[b]cyclobutene. The Journal of Organic Chemistry. 1969, s. 538–545. DOI 10.1021/jo01255a012.
- ↑ K. Alder; H. F. Rickert; E. Windemuth. Zur Kenntnis der Dien-Synthese, X. Mitteil.: Über die Dien-Synthese mit α, β-ungesättigten Nitrokörpern, Sulfonen und Thio-Äthern. Chemische Berichte. 1938, s. 2451–2461. DOI 10.1002/cber.19380711206.
- ↑ G. S. Andrade et al. The one-pot synthesis and Diels-Alder Reactivity of 2,5-dihydrothiophene-1,1-dioxide-3-carboxylic acid. Synthetic Communications. 2003, s. 3463–3650. DOI 10.1081/SCC-120024845.
- ↑ M. E. Brant; J. E. Wulff. 3-Sulfolenes and their derivatives: Synthesis and applications. Synthesis. 2016, s. 1–17. DOI 10.1055/s-0035-1560351.
- ↑ E. J. Goethals. On the polymerization and copolymerization of sulfolenes. Macromolecular Chemistry and Physics. 1967, s. 132–142. DOI 10.1002/macp.1967.021090113.
- ↑ Y. Huang et al. Butadiene sulfone as 'volatile', recyclable dipolar, aprotic solvent for conducting substitution and cycloaddition reactions. Sustainable Chemical Processes. 2015. DOI 10.1186/s40508-015-0040-7.
- ↑ a b H. J. Lehmler. Synthesis of environmentally relevant fluorinated surfactants—a review. Chemosphere. 2005, s. 1471–1496. DOI 10.1016/j.chemosphere.2004.11.078. PMID 15694468.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Sulfolen na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sulfolen na Wikimedia Commons