Dusičnan amonný: Porovnání verzí
m →Bezpečnost: .. deduplikace; typo |
m →Bezpečnost: správný odkaz na mezitím vzniklý článek |
||
| Řádek 51: | Řádek 51: | ||
* [[Neštěstí v Texas City]] (přístav v [[Mexický záliv|Mexickém zálivu]]) v [[Spojené státy americké|USA]] 16. dubna 1947 |
* [[Neštěstí v Texas City]] (přístav v [[Mexický záliv|Mexickém zálivu]]) v [[Spojené státy americké|USA]] 16. dubna 1947 |
||
* [[Exploze v Tchien-ťinu v srpnu 2015|Exploze v Tchien-ťinu]] (přístav ve [[Žluté moře|Žlutém moři]]) v [[Čínská lidová republika|Číně]] 12. srpna 2015 |
* [[Exploze v Tchien-ťinu v srpnu 2015|Exploze v Tchien-ťinu]] (přístav ve [[Žluté moře|Žlutém moři]]) v [[Čínská lidová republika|Číně]] 12. srpna 2015 |
||
* [[Výbuch v |
* [[Výbuch v bejrútském přístavu 2020|Výbuch v přístavu]] v [[Bejrút|Bejrútu]] ([[Středozemní moře]]) v [[Libanon|Libanonu]] 4. srpna 2020 <ref>[https://www.seznamzpravy.cz/clanek/exploze-v-bejrutu-nejmene-deset-mrtvych-a-stovky-zranenych-114760 Obří výbuch v Bejrútu: Desítky mrtvých, tlaková vlna působila až 25 km daleko]</ref> |
||
S ohledem na svou výbušnost je dusičnan amonný uveden v [[Seznam látek považovaných za prekurzory výbušnin|seznamu látek]] považovaných za [[Prekurzor (chemie)|prekurzory]] [[Výbušnina|výbušnin]], jejichž prodej nepodnikajícím [[Fyzická osoba|fyzickým osobám]] podléhá v [[Evropská unie|Evropské unii]] dozoru, aby bylo zabráněno jejich zneužití k nedovolené výrobě výbušnin.<ref>{{Citace elektronického periodika |
S ohledem na svou výbušnost je dusičnan amonný uveden v [[Seznam látek považovaných za prekurzory výbušnin|seznamu látek]] považovaných za [[Prekurzor (chemie)|prekurzory]] [[Výbušnina|výbušnin]], jejichž prodej nepodnikajícím [[Fyzická osoba|fyzickým osobám]] podléhá v [[Evropská unie|Evropské unii]] dozoru, aby bylo zabráněno jejich zneužití k nedovolené výrobě výbušnin.<ref>{{Citace elektronického periodika |
||
Verze z 5. 8. 2020, 12:11
| Dusičnan amonný | |
|---|---|
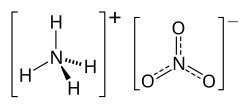 2D model molekuly NH4NO3 | |
 | |
| Obecné | |
| Systematický název | Dusičnan amonný |
| Triviální název | Ledek amonný |
| Ostatní názvy | Amoniumnitrát |
| Anglický název | Ammonium nitrate |
| Německý název | Ammoniumnitrat |
| Sumární vzorec | NH4NO3 |
| Vzhled | bílé krystalky nebo prášek |
| Identifikace | |
| Registrační číslo CAS | 6484-52-2 |
| Číslo RTECS | BR9050000 |
| Vlastnosti | |
| Molární hmotnost | 80,043 g/mol |
| Teplota tání | 169,6 °C |
| Teplota rozkladu | 210 °C |
| Hustota | 1,725 g/cm3 1,66 g/cm3 (170 °C) |
| Index lomu | α - modifikace nDa= 1,45 nDb= 1,59 nDc= 1,63 β - modifikace nD= 1,413 (20 °C) |
| Rozpustnost ve vodě | 117,43 g/100 ml (0 °C) 150 g/100 ml (10 °C) 189,87 g/100 ml (20 °C) 246,25 g/100 ml (32 °C) 421 g/100 ml (60 °C) 600 g/100 ml (80 °C) 871 g/100 ml (100 °C) |
| Rozpustnost v polárních rozpouštědlech | methanol 17,1 g/100 ml (20 °C) ethanol 3,80 g/100 ml (20 °C) aceton diethylether (ne) |
| Měrná magnetická susceptibilita | -5,2×10−6 cm3g-1 |
| Struktura | |
| Krystalová struktura | kosočtverečná (α) krychlová (β) tetragonální (γ) |
| Hrana krystalové mřížky | a= 575 pm b= 545 pm c= 496 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | -365,1 kJ/mol |
| Entalpie tání ΔHt | 80,0 J/g |
| Entalpie rozpouštění ΔHrozp | 321 J/g |
| Standardní molární entropie S° | 151 JK-1mol-1 |
| Standardní slučovací Gibbsova energie ΔGf° | -183,8 kJ/mol |
| Izobarické měrné teplo cp | 1,737 JK-1g-1 |
| Bezpečnost | |
| R-věty | R8,R36,R37,R38 |
| S-věty | S15,S16,S26,S36 |
| NFPA 704 |  0
2
3
OX
|
Některá data mohou pocházet z datové položky. | |
Dusičnan amonný, triviálním názvem ledek amonný či amoniumnitrát, je chemická sloučenina (dusičnan amoniaku) s chemickým vzorcem NH4NO3. Je to bílá krystalická látka používaná jako zemědělské hnojivo, dezinfekční prostředek vody a díky oxidačním vlastnostem také v pyrotechnice.
Bezpečnost
Dusičnan amonný se při zahřátí bezvýbušně rozkládá na oxid dusný („rajský plyn“) a vodní páru:
- NH4NO3 → N2O + 2 H2O
Jestliže však dojde k detonaci, je tento rozklad doprovázen výbuchem. Velké zásoby této látky mohou být také požárním rizikem, protože podporuje hoření, což může snadno vést až právě k detonaci. Výbuchy dusičnanu amonného nejsou vzácným jevem, k méně závažným případům dochází téměř každoročně. Zaznamenáno však bylo i několik rozsáhlých, zničujících výbuchů, k nimž se řadí:
- Exploze chemičky v Oppau (dnes součást města Ludwigshafen) v Německu 21. září 1921 (jeden z nejničivějších vyvolaných nenukleárních výbuchů v dějinách)
- Neštěstí v Texas City (přístav v Mexickém zálivu) v USA 16. dubna 1947
- Exploze v Tchien-ťinu (přístav ve Žlutém moři) v Číně 12. srpna 2015
- Výbuch v přístavu v Bejrútu (Středozemní moře) v Libanonu 4. srpna 2020 [1]
S ohledem na svou výbušnost je dusičnan amonný uveden v seznamu látek považovaných za prekurzory výbušnin, jejichž prodej nepodnikajícím fyzickým osobám podléhá v Evropské unii dozoru, aby bylo zabráněno jejich zneužití k nedovolené výrobě výbušnin.[2] Dusičnan amonný nelze podle tohoto nařízení prodávat ani držet samostatně ani ve směsích či látkách, v nichž je koncentrace dusíku pocházejícího z dusičnanu amonného větší nebo rovna 16 % hmotnostním.
Příprava
Dusičnan amonný může vznikat přeměnou močoviny:
Obvykle se však připravuje reakcí kyseliny dusičné a čpavku.[3]
- HNO3 + NH3 → NH4NO3.
Dusičnan amonný se také vyrábí amatérskými nadšenci reakcí:
- Ca(NO3)2 + (NH4)2SO4 → 2 NH4NO3 + CaSO4[zdroj?]
Tato reakce je silně exotermní. Lze ho také připravit reakcí AgNO3(aq) s NH4Cl(aq), přičemž vzniká jako nerozpustná sůl AgCl, která se dá odfiltrovat, takže výtěžek je pak poměrně vysoký.
Využití
- V zemědělství jako hnojivo
- V dezinfekci vod (vodovody, bazény)
- V pyrotechnice
Reference
- ↑ Obří výbuch v Bejrútu: Desítky mrtvých, tlaková vlna působila až 25 km daleko
- ↑ Nařízení Evropského parlamentu a Rady (EU) 2019/1148 ze dne 20. června 2019 o uvádění prekurzorů výbušnin na trh a o jejich používání, změně nařízení (ES) č. 1907/2006 a zrušení nařízení (EU) č. 98/2013. EUR-Lex [online]. [cit. 2020-08-04]. Dostupné online.
- ↑ Process_of_producing_concentrated_soluti
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.

