Oxidační číslo: Porovnání verzí
m {{Překlad}} hned pod nadpis Reference; kosmetické úpravy |
m Bot: Odstranění 52 odkazů interwiki, které jsou nyní dostupné na Wikidatech (d:q484152) |
||
| Řádek 69: | Řádek 69: | ||
[[Kategorie:Chemické veličiny]] |
[[Kategorie:Chemické veličiny]] |
||
[[af:Oksidasietoestand]] |
|||
[[an:Numero d'oxidación]] |
|||
[[be:Ступень акіслення]] |
|||
[[be-x-old:Ступень затляненьня]] |
|||
[[bg:Степен на окисление]] |
|||
[[bs:Oksidacijsko stanje]] |
|||
[[ca:Estat d'oxidació]] |
|||
[[ckb:ژمارەی ئۆکسان]] |
|||
[[da:Oxidationstrin]] |
|||
[[de:Oxidationszahl]] |
|||
[[en:Oxidation number]] |
|||
[[eo:Oksidiĝa nombro]] |
|||
[[es:Estado de oxidación]] |
|||
[[et:Oksüdatsiooniaste]] |
|||
[[eu:Oxidazio-egoera]] |
|||
[[fa:عدد اکسایش]] |
|||
[[fi:Hapetusluku]] |
|||
[[fr:Nombre d'oxydation]] |
|||
[[gl:Estado de oxidación]] |
|||
[[he:מספר חמצון]] |
|||
[[ht:Degre oksidasyon]] |
|||
[[hu:Oxidációs szám]] |
|||
[[id:Bilangan oksidasi]] |
|||
[[is:Oxunartala]] |
|||
[[it:Stato di ossidazione]] |
|||
[[ja:酸化数]] |
|||
[[jbo:kijytcini]] |
|||
[[ka:ჟანგვის რიცხვი]] |
|||
[[kk:Тотығу дәрежесі]] |
|||
[[ko:산화수]] |
|||
[[lt:Oksidacijos laipsnis]] |
|||
[[lv:Oksidēšanas pakāpe]] |
|||
[[mk:Оксидационен број]] |
|||
[[nds:Oxidatschoonstall]] |
|||
[[nl:Oxidatietoestand]] |
|||
[[nn:Oksidasjonstal]] |
|||
[[no:Oksidasjonstall]] |
|||
[[pl:Stopień utlenienia]] |
|||
[[pt:Estado de oxidação]] |
|||
[[ro:Număr de oxidare]] |
|||
[[ru:Степень окисления]] |
|||
[[sh:Oksidacioni broj]] |
|||
[[sk:Oxidačné číslo]] |
|||
[[sl:Oksidacijsko stanje]] |
|||
[[sr:Оксидациони број]] |
|||
[[sv:Oxidationstal]] |
|||
[[ta:ஆக்சிசனேற்ற எண்]] |
|||
[[th:สถานะออกซิเดชัน]] |
|||
[[uk:Ступінь окиснення]] |
|||
[[ur:تکسیدی عدد]] |
|||
[[uz:Oksidlanish darajasi]] |
|||
[[zh:氧化数]] |
|||
Verze z 8. 3. 2013, 04:59
Oxidační číslo (nebo také mocenství, oxidační stav či stupeň) definuje součet pozitivních a negativních nábojů v atomu. Nepřímo udává počet přijatých, nebo odevzdaných elektronů. Smysl toto číslo má jen v případě, že se atom účastní iontové polární vazby.
Pokud elektrony přijímá, je toto číslo záporné a pak se jedná o anion, pokud je odevzdává, je číslo kladné a jde o kation. Atom v základním stavu má oxidační číslo rovné nule. Atom jednoho prvku může mít různá oxidační čísla podle toho, v jaké sloučenině se zrovna nachází. Existují však přehledy důležitých oxidačních čísel.
Definice oxidačního čísla podle IUPAC:[1]
"Oxidační číslo: Udává stupeň oxidace atomu ve sloučenině. Je definováno jako náboj, který by atom měl, pokud bychom mu přisoudili elektrony podle následujících pravidel: (1) oxidační stav volných (nevázaných) prvků je roven nule; (2) jednoduché (jednoatomové) ionty mají oxidační číslo rovno náboji; (3) v běžných sloučeninách má vodík oxidační číslo +1 a kyslík -2. (Výjimku z tohoto pravidla tvoří pro vodík hydridy, kde je oxidační číslo vodíku -1, výjimkou pro kyslík jsou peroxidy, kde dosahuje oxidačního čísla -1); (4) algebraický součet oxidačních čísel v neutrální molekule musí být roven nule, v případě iontu se musí součet rovnat náboji iontu. Například, oxidační čísla síry ve sloučeninách H2S, S8, SO2, SO3 a H2SO4 jsou: -2, 0, +4, +6 a +6. Čím je oxidační číslo atomu ve sloučenině vyšší, tím je vyšší i stupeň oxidace daného atomu. Naopak, čím je oxidační číslo nižší, tím je vyšší stupeň redukce."
Výpočet formálního oxidačního stavu
Existují dvě běžně používané metody pro výpočet oxidačního stavu atomu ve sloučenině. První se využívá u sloučenin, které mají Lewisovskou strukturu, jako např. organické molekuly. Druhá je použitelná pro jednoduché sloučeniny.
Je důležité si uvědomit, že oxidační číslo atomu neodpovídá jeho reálnému náboji. Tyto dvě veličiny si odpovídají pouze u vysokých oxidačních čísel, kde je ionizační energie mnohem vyšší než energie chemických reakcí. Přiřazování vazebných elektronů jednotlivým atomům pomocí oxidačního čísla je čistě formální, ale je to velmi užitečné pro pochopení mnoha chemických reakcí.
Výpočet z Lewisovské struktury
Pokud známe Lewisovskou strukturu molekuly, můžeme jednoznačně určit oxidační stav atomů jako rozdíl mezi počtem valenčních elektronů neutrálního atomu a počtem elektronů, které atomu „patří“ ve vázaném stavu. Pro výpočet oxidačního stavu uvažujeme, že elektrony z vazby mezi dvěma různými prvky patří elektronegativnějšímu atomu a elektrony z vazby mezi stejnými atomy se dělí rovným dílem.
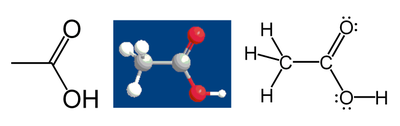
Například kyselina octová:
Uhlík z methylové skupiny má šest valenčních elektronů z vazeb k atomům vodíku, protože je více elektronegativní. Další elektron získá z vazby k atomu uhlíku karboxylové skupiny. Celkem mu tedy náleží sedm elektronů. Neutrální atom uhlíku má čtyři elektrony. Rozdíl, 4 − 7 = −3, je oxidační číslo atomu uhlíku.
Výpočet bez využití Lewisovské struktury
Algebraický součet oxidačních čísel atomů v neutrální molekule musí být roven nule, v případě iontu se musí rovnat jeho náboji. Tento fakt spolu se skutečností, že některé prvky mají téměř vždy určitá oxidační čísla, umožňuje určit oxidační stav prvků v jednoduchých molekulách.
- Fluor má vždy oxidační číslo -1, protože je to nejelektronegativnější prvek.
- Vodík má běžně oxidační číslo +1, s výjimkou sloučenin, kde je vázán k elektropozitivnějšímu prvku (NaH, NaBH4, ...), kde má potom oxidační číslo -1.
- Kyslík má oxidační číslo -2, výjimku tvoří peroxidy (-1), superoxidy (-1/2), ozonidy (-1/3), difluorid kyslíku OF2 (+2) a difluorid dikyslíku O2F2 (+1).
- Alkalické kovy mají oxidační stav +1, výjimku tvoří pouze alkalidy.
- Kovy alkalických zemin mají vždy oxidační číslo +2.
- Halogeny, mají oxidační číslo -1, pokud nejsou vázány ke kyslíku, dusíku nebo elektropozitivnějšímu halogenu.
Příklad: V molekule Cr(OH)3, má kyslík oxidační číslo -2 a vodík +1. Tři hydroxidové skupiny mají tedy náboj -3. Jelikož se jedná o neutrální molekulu musí být oxidační stav chromu +3.
Přípony podle oxidačního čísla
V názvech anorganických sloučenin se oxidační číslo významného prvku zohledňuje příponou. Například v chloridu železitém má atom železa oxidační číslo 3 (-itý).
| oxidační číslo | přípona | příklad |
|---|---|---|
| +I | -ný | chlorid sodný |
| +II | -natý | sulfid olovnatý |
| +III | -itý | oxid hlinitý, kyselina boritá |
| +IV | -ičitý | kyselina křemičitá, oxid dusičitý |
| +V | -ičný, -ečný | kyselina jodičná, oxid vanadičný, oxid fosforečný |
| +VI | -ový | oxid sírový |
| +VII | -istý | kyselina chloristá |
| +VIII | -ičelý | oxid osmičelý |
| +IX | -utý | fluorid iridutý (toto oxidační číslo je zatím jen teoretické a mohlo by se vyskytovat i u meitneria) [2] |
Reference
V tomto článku byl použit překlad textu z článku Oxidation state na anglické Wikipedii.