Retro Dielsova–Alderova reakce
Retro Dielsova–Alderova reakce, zkráceně rDA reakce, je děj opačný k Dielsově–Alderově (DA) reakci. Spočívá ve vzniku dienu a dienofilu z cyklohexenu nebo jeho derivátu. Může probíhat samovolně po zahřátí, případně působením kyseliny nebo zásady.[1][2]
Tato reakce je termodynamicky výhodnější než Dielsova–Alderova reakce, pokud teplota dosáhne určité hodnoty. Obvykle je ale potřeba použít několik úprav, aby probíhala za synteticky využitelných teplot; například štěpení cyklohexenu na butadien a ethen probíhá pouze za teplot nad 800 K.[3]
Retro Dielsovy–Alderovy reakce lze ovšem také uskutečnit za poměrně mírných podmínek. V roce 1929 byl tento postup použit při detekci cyklohexadienů za uvolnění ethenu a aromatických sloučenin po reakci s acetyleny v posloupnosti Dielsových–Alderových/retro Dielsových–Alderových reakcí.[4]
Od této doby byly provedeny rDA řady různých substrátů a tvorby mnoha dienů a dienofilů. Pokud reakce probíhá za přítomnosti určitého typu dienu nebo dienofilu, tak lze zachytit různé reaktivní meziprodukty.[5]

Mechanismus[editovat | editovat zdroj]
Retro-Dielsovy–Alderovy reakce jsou mikroskopickými opaky Dielsových–Alderových reakcí: soustředěné, pericyklické a jednokrokové. Důkazy o průběhu retro-Dielsových–Alderových reakcí byly získány přes endo-exo izomerizace produktů rekcí Dielsových–Alderových.[6]
Izomerizace kinetických endo aduktů za vysokých teplot na termodynamicky stálejší exo produkty probíhají přes posloupnosti rDA/DA. Tyto izomerizace mohou ale být i zcela vnitromolekulární, [3,3]-sigmatropní.[7]
Stereochemie[editovat | editovat zdroj]
Podobně jako Dielsovy–Alderovy reakce i rDA zachovávají konfiguraci dienu a dienofilu. Jen málo je známo o vzájemném poměru endo a exo produktů a studie nezjistily žádnou souvislost mezi relativní konfigurací použitého cyklohexenu a tímto poměrem.[8]
Možnosti a omezení[editovat | editovat zdroj]
Několik málo rDA reakcí probíhá samovolně za pokojové teploty, protože vznikající dienofil je značně reaktivní nebo těkavý; většinou je ale potřeba tepelná nebo chemická aktivace. Relativní náchylnost různých dienů a dienofilů k tvorbě prostřednictvím rDA je takováto:
Dieny: furan, pyrrol > benzen > naftalen > fulven > cyklopentadien > antracen > buta-1,3-dien
Dienofily: N2 > CO2 > naftalen > benzen, nitrily > methakryláty > maleimidy > cyklopentadien, iminy, alkeny > alkyny
Plně uhlíkaté dienofily[editovat | editovat zdroj]
Protože se při Dielsových–Alderových reakcích vyměňují dvě vazby π za dvě vazby σ, tak jsou tepelně výhodnější než zpětné reakce; byla však vyvinuta řada postupů umožňujících překonat tuto termodynamickou překážku. Tvorba komplexu s Lewisovou kyselinou na zásaditou skupinu výchozí látky může usnadnit retro Dielsovu–Alderovu reakci i tehdy, když je přímá reakce vnitromolekulární.[9]
Zásady mohou řídit rDA tehdy, když jsou produkty méně zásadité než výchozí látky. Tento postup byl například použit na přípravu aromatických cyklopentadienylových aniontů z derivátů cyklopentadienu.[10]
Vhodně umístěné skupiny odtahující elektrony na výchozím materiálu mohou způsobit, že bude tento proces nevratný.
Pokud je třeba izolovat nebo nechat reagovat nezachytitelný dien či dienofil, tak lze použít jeden ze dvou postupů. Vakuová pyrolýza Dielsových–Alderových aduktů může vytvořit vysoce reaktivní dienofily, jež lze poté zachytit pomocí dienu.[11]
rDA reakce mohou také probíhat za přítomnosti vhodných zachytávajících molekul, které reaguji s dienem nebo (častěji) dienofilem a posouvají rovnováhu retro-DA směrem k produktům. Velmi reaktivní kyanoakryláty lze takto odizolovat od (zvlášť vytvořených) Dielsových–Alderových aduktů.[12]
Heteroatomové dienofily[editovat | editovat zdroj]
Nitrily lze získat rDA reakcemi DA aduktů pyrimidinů nebo pyrazinů. Vzniklé vysoce substituované pyridiny se často jinými způsoby získávají obtížně.[13]
Uvolnění izokyanátů z Dielsových–Alderových aduktů pyridonů lze použít na přípravu vysoce substituovaných aromatických sloučenin. Izokyanáty lze izolovat nebo zachytit.[14]
Uvolnění dusíku z šestičlenných cyklických diazenů jsou častá a mnohdy samovolná i za pokojové teploty. V následujícím případě epoxid procházel rDA při 0 °C. Izomer s diazenovou a epoxidovou skupinou ve vzájemné poloze cis reaguje pouze po zahřátí nad 180 °C.[15]
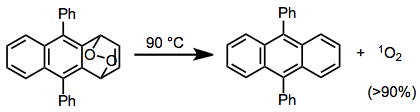
 Kyslík uvolněný prostřednictvím rDA bývá singletový. Vysoké výtěžky singletového kyslíku (přes 90 %) byly dosaženy při rDA reakcích některých cyklických peroxidů.[16]
Kyslík uvolněný prostřednictvím rDA bývá singletový. Vysoké výtěžky singletového kyslíku (přes 90 %) byly dosaženy při rDA reakcích některých cyklických peroxidů.[16]
Častým dienofilem vznikajícím při rDA reakcích je oxid uhličitý. Dielsovy–Alderovy adukty alkynů a 2-pyronů mohou vstupovat do rDA za vzniku oxidu uhličitého a aromatických sloučenin.[17]
Podmínky reakce[editovat | editovat zdroj]
Průběh rDA reakcí řídí vnitřní energie a teplota bývá často jedinou veličinou udávanou u reakčních podmínek, nejsou tak určeny žádné „obvyklé“ podmínky. rDA reakce vytvářející těkavé produkty lze zrychlit jejich odstraňováním, i když je většina těchto reakcí (například uvolňujících dusík a kyslík) nevratných i bez této podpory.
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Retro-Diels–Alder reaction na anglické Wikipedii.
- ↑ B. Rickborn. The Retro–Diels–Alder Reaction. Part I. C–C Dienophiles. Organic Reactions. 1998, s. 1–393. ISBN 978-0471264187. DOI 10.1002/0471264180.or052.01.
- ↑ B. Rickborn. The Retro-Diels-Alder Reaction. Part II. Dienophiles with One or More Heteroatom. Organic Reactions. 1998, s. 223–629. ISBN 978-0471264187. DOI 10.1002/0471264180.or053.02.
- ↑ Masao Uchiyama; Tadao Tomioka; Akira Amano. Thermal Decomposition of Cyclohexene. The Journal of Physical Chemistry. 2002-05-01, s. 1878–1881. DOI 10.1021/j100789a036.
- ↑ O. Diels; K. Alder; G. Stein; P. Pries; H. Winckler. Synthesen in der hydroaromatischen Reihe, VI. Mitteilung, Kurt Alder und Gerhard Stein: Über partiell hydrierte Naphtho- und Anthrachinone mit Wasserstoff in γ- bzw. δ-Stellung. (Mitbearbeitet von Paul Pries und Hans Winckler). Chemische Berichte. 1929, s. 2337. DOI 10.1002/cber.19290620872.
- ↑ A. Ichihara. Retro-Diels-Alder Strategy in Natural Product Synthesis. Synthesis. 1987, s. 207–222. DOI 10.1055/s-1987-27894.
- ↑ K. Alder; H. F. Rickert. Zur Kenntnis der Dien-synthese. I. Über eine Methode der direkten Unterscheidung cyclischer Penta- und Hexa-diene. Justus Liebigs Annalen der Chemie. 1936, s. 180–189. DOI 10.1002/jlac.19365240109.
- ↑ J. Haslouin; F. Rouessac. Bulletin de la Société Chimique de France. 1977, s. 1242.
- ↑ A. R. Rye; D. Wege. Preparation and thermolysis of exo-and endo-Tricyclo[6,2,1,02,7] undeca-3,5,9-triene. Australian Journal of Chemistry. 1974, s. 1943. DOI 10.1071/CH9741943.
- ↑ C. Rogers; B. A. Keay. Catalytic methylaluminum dichloride: An efficient method for accelerating the intramolecular Diels-Alder reaction of the furan diene. Tetrahedron Letters. 1991, s. 6477. Dostupné online. DOI 10.1016/0040-4039(91)80197-E.
- ↑ W. Neukam; W. Grimme. Anionic (4+2)-cycloreversions leading to the cyanocyclopentadienide ion. Tetrahedron Letters. 1978, s. 2201. DOI 10.1016/S0040-4039(01)86845-3.
- ↑ M. Ahmar; I. Romain; R. Bloch. Efficient and highly stereoselective syntheses of enantiomerically enriched C(1)-C(7) subunits of erythronolides. The Journal of Organic Chemistry. 1993, s. 2953. DOI 10.1021/jo00063a009.
- ↑ C. J. J. Buck. Unequivocal synthesis of bis(2-cyanoacrylate) monomers. I. Via anthracene adducts. Journal of Polymer Science: Polymer Chemistry Edition. 1978, s. 2475–2507. DOI 10.1002/pol.1978.170161007. Bibcode 1978JPoSA..16.2475B.
- ↑ J. C. J. Martin. Unequivocal synthesis of bis(2-cyanoacrylate) monomers. I. Via anthracene adducts. Journal of Heterocyclic Chemistry. 1980, s. 1111–1112. DOI 10.1002/jhet.5570170554.
- ↑ K. Afarinkia; V. Vinader; T. D. Nelson; G. H. Posner. Diels-Alder cycloadditions of 2-pyrones and 2-pyridones. Tetrahedron. 1992, s. 9111. DOI 10.1016/S0040-4020(01)85607-6.
- ↑ Y. Liao; J. B. White. An examination of the affect of the epoxide stereochemistry in the nitrogen extrusion from exo- and endo-6,7-diazo-3-oxotricyclo[3.2.2.02,4]Non-6-ene. Tetrahedron Letters. 1990, s. 5129. DOI 10.1016/S0040-4039(00)97822-5.
- ↑ N. J. Turro; M. F. Turro. Magnetic field effects on the thermolysis of endoperoxides of aromatic compounds. Correlations with singlet oxygen yield and activation entropies. Journal of the American Chemical Society. 1979, s. 3701. DOI 10.1021/ja00507a067.
- ↑ H. Sakurai; Y. Eriyama; A. Hosomi; Y. Nakadaira; C. Kabuto. Preparation and reactions of dodecamethyl-3,4,7,8,11,12-hexasilacyclododeca-1,5,9-triyne. Chemical Letters. 1984, s. 595–598. DOI 10.1246/cl.1984.595.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Retro Dielsova–Alderova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Retro Dielsova–Alderova reakce na Wikimedia Commons