Liebeskindova–Šroglova reakce
Liebeskindova–Šroglova reakce je organická reakce thioesteru a boronové kyseliny katalyzovaná kovem, patřící mezi křížová párování.[1]
Reakci objevili dva chemici, český Jiří Šrogl a americký Lanny S. Liebeskind. Reakce má tři generace, na následujícím obrázku je zobrazena první. Používají se Pd0 katalyzátory, TFP (tris(2-furyl)fosfin) a další ligand a stechiometrický kokatalyzátor thiofen-2-karboxylát měďný (CuTC). Následuje obecné schéma reakce:
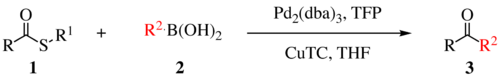
Při Liebeskindových-Šroglových reakcích se používají thioetherové a thioesterové elektrofily a boronové kyseliny nebo stannany jako nukleofily, lze však použít i jiné reaktanty, kromě alkyl- a arylthioesterů může jít i o (hetero)arylthioethery, thioamidy, thioalkyny a thiokyanáty.[2] Do reakce také mohou vstoupit téměř všechny vazby kov-R schopné transmetalace.[2]
Indiové nukleofily nevyžadují přítomnost mědi nebo zásady, jsou však uplatnitelné pouze u první generace, protože druhá a třetí jsou mechanisticky odlišné, navíc probíhají pouze u thioesterů schopných vytvořit šestičlenné metalocykly.

Reakce první generace probíhají za nepřístupu vzduchu, s použitím stechiometrických množství mědi a s palladiovými katalyzátory.[1]
Reakce druhé generace jsou katalyzovány mědí za přítomnosti dodatečného ekvivalentu za přístupu vzduchu a nepřítomnosti palladia.[3] Přidaný ekvivalent oddělí měď od sirné sloučeniny a umožní tím dokončení katalytického cyklu. Tento druh je omezen na thioestery a thioethery a může být také limitován dostupností organoboranu.
Reakce třetí generace mají jako katalyzátor sloučeninu mědi a využívají jediný ekvivalent boronové kyseliny.[4]
Mechanismus[editovat | editovat zdroj]
První generace[editovat | editovat zdroj]
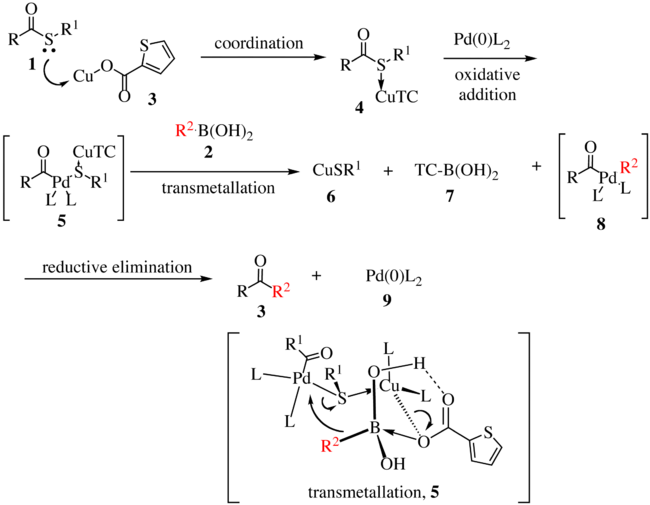
Níže je zobrazen navržený mechanismus Liebeskindovy–Šroglovy reakce první generace.[5][6]
Thioester 1 reaguje se sloučeninou 3 a vytvoří komplex 4. Oxidační adicí palladia na vazbu uhlík–síra vznikne meziprodukt 5, z něhož se transmetalací vytvoří organopalladiová sloučenina 8. Transmetalace probíhá skrz přesun R2 na palladiové centrum se současným přesunem atomu síry na měďný komplex. Následně se redukční eliminací utvoří keton 3 a obnoví katalyzátor 9.
Druhá generace[editovat | editovat zdroj]
Na následujícím obrázku je znázorněn mechanismus druhé generace;[3] neodpovídá běžné posloupnosti oxidační adice-transmetelace-redukční eliminace, jako je tomu u první generace. Společně se zkoumáním reakcí měďných sloučenin s dikyslíkem byl navržen mechanismus zahrnující Cu ve vyšším oxidačním čísle.[7][8][9][10]
Po koordinaci na thioester se Cu+ oxiduje na měďnato-měditý meziprodukt, který funguje jako Lewisova kyselina, jež aktivuje thioester a zajišťuje přesun R2 (buď přímo z atomu boru nebo přes meziprodukt typu Cu-R2), čímž vznikne keton a Cu-thiolát. Druhý ekvivalent boronové kyseliny zajistí rozštěpení vazby Cu-S a uvolnění mědi zpět do katalytického cyklu.

Třetí generace[editovat | editovat zdroj]
Třetí generace je založená na katalýze mědí s použitím jediného ekvivalentu boronové kyseliny, čímž napodobuje metallothioneinový (MT) systém, který odstraňuje kovy z organismů.[4] Thiopomocník obsahuje vazbu N-O, která napodobuje vazbu S-S u MT, provádí přitom nezbytné štěpení vazby měď-síra a zajišťuje tím obnovu katalyzátoru. Tato varianta se podporuje působením mikrovlnného záření a nezahrnuje palladium. Pravděpodobně se mechanismem podobá druhé generaci (ke znázornění je použita aktivní sloučenina Cu+-R2, R2 lze však přesunout přímo na boronovou kyselinu), ale měď zpět do katalytického cyklu uvolňuje thiopomocník, nikoliv další ekvivalent boronové kyseliny.

Využití[editovat | editovat zdroj]
Liebeskindova–Šroglova párování jsou součástmi několika totálních syntéz, příkladem může být syntéza goniodominu A.[11]

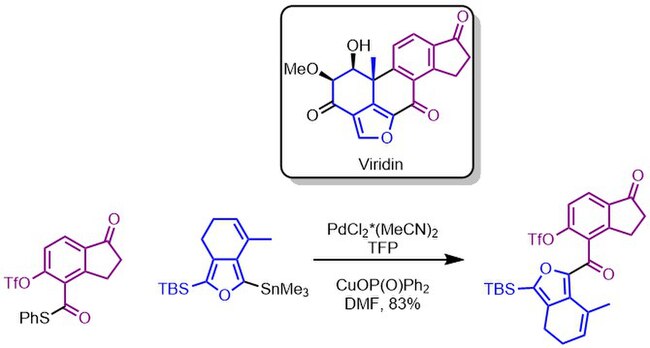
Liebeskindovo–Šroglovo párování bylo také použito k vytvoření uhlíkatého řetězce viridinu s vysokou výtěžností v několikagramovém měřítku.[12]
Další látkou připravenou s využitím této reakce je amfidinolid F,[13] Liebeskindovou-Šroglovou reakcí zde byl vytvořen „severovýchodní“ fragment makrocyklu a terpenový řetězec.

Řízená difunkcionalizace[editovat | editovat zdroj]
Sloučeniny obsahující dvě thioetherové vazby mohou být na jedné z nich selektivně funkcionalizované za přítomnosti jednoho ekvivalentu nukleofilu, jestliže je přítomna karbonylová skupina.[14]
Tato reakce probíhá přes pětičlenný palladacyklus, u kterého probíhá oxidační adice do polohy cis. Další ekvivalent nukleofilu vyvolá funkcionalizaci v poloze trans.

Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Liebeskind–Srogl coupling na anglické Wikipedii.
- ↑ a b L. Liebeskind; Jiri Srogl. Thiol Ester−Boronic Acid Coupling. A Mechanistically Unprecedented and General Ketone Synthesis. Journal of the American Chemical Society. 2000, s. 11260–11261. DOI 10.1021/ja005613q.
- ↑ a b Hong-Gang Cheng; Han Chen; Yue Liu; Qianghui Zhou. The Liebeskind-Srogl Cross-Coupling Reaction and its Synthetic Applications. Asian Journal of Organic Chemistry. 2018, s. 490–508. DOI 10.1002/ajoc.201700651.
- ↑ a b Janette M. Villalobos; Jiri Srogl; Lanny S. Liebeskind. A New Paradigm for Carbon−Carbon Bond Formation: Aerobic, Copper-Templated Cross-Coupling. Journal of the American Chemical Society. 2007, s. 15734–15735. ISSN 0002-7863. DOI 10.1021/ja074931n. PMID 18047333.
- ↑ a b Zhihui Zhang; Matthew G. Lindale; Lanny S. Liebeskind. Mobilizing Cu(I) for Carbon−Carbon Bond Forming Catalysis in the Presence of Thiolate. Chemical Mimicking of Metallothioneins. Journal of the American Chemical Society. 2011-04-27, s. 6403–6410. ISSN 0002-7863. DOI 10.1021/ja200792m. PMID 21449537.
- ↑ Y. Yu; L. S. Liebeskind. Copper-mediated, palladium-catalyzed coupling of thiol esters with aliphatic organoboron reagents. The Journal of Organic Chemistry. 2004, s. 3554–3557. DOI 10.1021/jo049964p. PMID 15132570.
- ↑ J. M- Villalobos; J. Srogl; L. S. Liebeskind. A new paradigm for carbon–carbon bond formation: aerobic, copper-templated cross-coupling. Journal of the American Chemical Society. 2007, s. 15734–15735. DOI 10.1021/ja074931n. PMID 18047333.
- ↑ Lanying Q. Hatcher; Michael A. Vance; Amy A. Narducci Sarjeant; Edward I. Solomon; Kenneth D. Karlin. Copper−Dioxygen Adducts and the Side-on Peroxo Dicopper(II)/Bis(μ-oxo) Dicopper(III) Equilibrium: Significant Ligand Electronic Effects. Inorganic Chemistry. 2006, s. 3004–3013. ISSN 0020-1669. DOI 10.1021/ic052185m. PMID 16562956.
- ↑ Liviu M. Mirica; Deanne Jackson Rudd; Michael A. Vance; Edward I. Solomon; Keith O. Hodgson; Britt Hedman; T. Daniel P. Stack. μ-η2:η2-Peroxodicopper(II) Complex with a Secondary Diamine Ligand: A Functional Model of Tyrosinase. Journal of the American Chemical Society. 2006, s. 2654–2665. ISSN 0002-7863. DOI 10.1021/ja056740v. PMID 16492052.
- ↑ Takahiro Matsumoto, Hideki Furutachi, Masashi Kobino, Masato Tomii, Shigenori Nagatomo, Takehiko Tosha, Takao Osako, Shuhei Fujinami, Shinobu Itoh. Intramolecular Arene Hydroxylation versus Intermolecular Olefin Epoxidation by (μ-η2:η2-Peroxo)dicopper(II) Complex Supported by Dinucleating Ligand. Journal of the American Chemical Society. 2006, s. 3874–3875. ISSN 0002-7863. DOI 10.1021/ja058117g. PMID 16551071.
- ↑ Elizabeth A. Lewis; William B. Tolman. Reactivity of Dioxygen−Copper Systems. Chemical Reviews. 2004, s. 1047–1076. ISSN 0009-2665. DOI 10.1021/cr020633r. PMID 14871149.
- ↑ Tomoyuki Saito; Haruhiko Fuwa; Makoto Sasaki. Toward the Total Synthesis of Goniodomin A, An Actin-Targeting Marine Polyether Macrolide: Convergent Synthesis of the C15−C36 Segment. Organic Letters. 2009-11-19, s. 5274–5277. ISSN 1523-7060. DOI 10.1021/ol902217q. PMID 19905029.
- ↑ Matthew Del Bel; Alexander R. Abela; Jeffrey D. Ng; Carlos A. Guerrero. Enantioselective Chemical Syntheses of the Furanosteroids (−)-Viridin and (−)-Viridiol. Journal of the American Chemical Society. 2017-05-24, s. 6819–6822. ISSN 0002-7863. DOI 10.1021/jacs.7b02829. PMID 28463562.
- ↑ Laurent Ferrié; Johan Fenneteau; Bruno Figadère. Total Synthesis of the Marine Macrolide Amphidinolide F. Organic Letters. 2018, s. 3192–3196. Dostupné online. ISSN 1523-7060. DOI 10.1021/acs.orglett.8b01020. PMID 29762038.
- ↑ Weiwei Jin; Wangming Du; Qin Yang; Haifeng Yu; Jiping Chen; Zhengkun Yu. Regio- and Stereoselective Synthesis of Multisubstituted Olefins and Conjugate Dienes by Using α-Oxo Ketene Dithioacetals as the Building Blocks. Organic Letters. 2011-08-19, s. 4272–4275. ISSN 1523-7060. DOI 10.1021/ol201620g. PMID 21761823.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Liebeskindova–Šroglova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Liebeskindova–Šroglova reakce na Wikimedia Commons
