Fétizonova oxidace
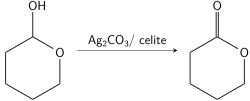
Fétizonova oxidace je organická reakce sloužící k oxidaci primárních a sekundárních alkoholů za použití uhličitanu stříbrného adsorbovaného na křemelině; tato forma uhličitanu stříbrného se někdy označuje jako Fétizonovo činidlo, jeho využití objevil Marcel Fétizon v roce 1968.[1]
Toto činidlo lze použít u substrátů citlivých na přítomnost kyselin či zásad. Snadno reaguje s laktoly a Fétizonovy oxidace jsou tak často používanými způsoby přípravy laktonů z diolů. Reakci zpomalují polární funkční skupiny a také sterické efekty u α-vodíků alkoholů.
Příprava činidla[editovat | editovat zdroj]
Fétizonovo činidlo se obvykle připravuje přidáním dusičnanu stříbrného do vodného roztoku uhličitanu, například sodného[2] nebo draselného,[3] přičemž se reakční směs promíchává za přítomnosti přečištěné křemeliny.
Mechanismus[editovat | editovat zdroj]
Navržený mechanismus oxidace alkoholu Fétizonovým činidlem zahrnuje jednoelektronovou oxidaci alkoholového kyslíku i vodíkového atomu v poloze alfa vůči alkoholu dvojicí stříbrných iontů; tato část probíhá na povrchu křemeliny. Následně je uhličitanový ion deprotonován na výslednou karbonylovou sloučeninu za tvorby hydrogenuhličitanu, což ná za následek eliminaci vody a vznik oxidu uhličitého.[4]


Krokem určujícím rychlost reakce by mělo být úvodní spojení alkoholu se stříbrnými ionty; i při slabém navázání ligandů na stříbro se reakce výrazně zpomaluje, i mírně polární rozpouštědla, jako jsou ethylacetát a ethylmethylketon, tak mohou reakci narušovat.[5] Neměly by se používat ani reaktanty obsahující jiné polární funkční skupiny, protože i alkenové skupiny mohou reaktivitu substrátu snížit až 50krát.[6] Obvykle se tak používají silně nepolární rozpouštědla, například benzen a xylen; dalšího urychlení lze dosáhnout pomocí ještě méně polárního heptanu.[6] Rozpouštědlo je také většinou refluxováno a vznikající voda se odstraňuje azeotropní destilací.
Sterické efekty na vodíku v poloze alfa vůči alkoholu mají na rychlost oxidace velký vliv, protože usnadňují navazování na stříbro.[5] Terciární alkoholy neobsahující alfa vodíky se tak obvykle Fétizonovým činidlem neoxidují.[7]

Zvýšení množství křemeliny vede k urychlení reakce, protože se zvětší povrch, na kterém může probíhat; navýšení nad 900 gramů na mol uhličitanu stříbrného sle reakci zpomaluje, protože dochází ke zřeďování.[5]
Reaktivita[editovat | editovat zdroj]
Fétizonovo činidlo slouží hlavně k oxidacím primárních alkoholů na aldehydy a sekundárních na ketony, přičemž vykazuje mírnou selektivitu vůči sekundárním[8] a nenasyceným alkoholům.[1] Reakční směs se intenzivně promíchává. Doba reakce závisí na struktuře alkoholu, ale nebývá delší než 3 hodiny. Fétizonovo činidlo lze od produktů oddělit filtrací a promytím benzenem. Jelikož Fétizonovo činidlo neoxiduje terciární alkoholy, tak má využití při monooxidacích 1,2-diolů, které mají jednu terciární alkoholovou skupinu, aniž by došlo ke štěpení vazeb uhlík-uhlík.[7]

Díky své strukturní citlivosti je toto činidlo vhodné také k monooxidacím symetrických diolů.[8]

Laktoly jsou na Fétizonovo činidlo vysoce citlivé a laktonové skupiny se oxidují velmi rychle., což umožňuje selektivní oxidaci laktolů oproti jiným alkoholům[9] a také přípravu laktonů z primárních diolů. Po oxidaci jednoho alkoholu na aldehyd druhý alkohol vytvoří rovnováhu s aldehydem za vzniku laktolu, který poté reaguje s další Fétizonovým činidlem a vytvoří lakton.[8] Tímto způsobem je možné připravit sedmičlenné laktony, což je u jiných postupů obtížné.[10]

Fenoly lze Fétizonovým činidlem oxidovat na příslušné chinony a ty dále zapojit do dimerizací, jejichž průběh závisí na substituentech.[2]

Aminy jsou za přítomnosti Fétizonova činidla oxidovány na enaminy[11] a iminiové kationty, které lze zachytit[12] a oddělit od sloučenin se snadněji oxidovatelnými alkoholovými skupinami.[13]
Fétizonovo činidlo může také zprostředkovávat cykloadiční reakce 4-hydroxy-2-furochinilonu s alkeny za vzniku dihydrofurochinolinonů.[14]
Chránicí skupiny[editovat | editovat zdroj]
Častou chránicí skupinou alkoholů proti Fétizonovu činidlu je para-methoxybenzyl (PMB).[15] Protože Fétizonova oxidace probíhá v neutrálním prostředí, tak reaktanty a produkty mohou rovněž obsahovat skupiny citlivé na kyseliny či zásady.
Citlivé skupiny[editovat | editovat zdroj]
Zatímco terciární alkoholy Fétizonovo činidlo obvykle neovlivňuje, tak propargylalkoholy se oxidují a vytváří fragmenty prostřednictvím alkynových odstupujících skupin.[16]

Trans-halohydriny vytvářejí epoxidy. Cis-halohydriny procházejí běžnými Fétizonovými oxidacemi na ketony.[17]

1,3-dioly odštěpují vodu a následně podléhají monooxidacím na enony.[8]

1,2-dioly se Fétizonovým činidlem mohou oxidovat na diony, objevit se však může i oxidační štěpení vazby uhlík-uhlík.[18][19]
Využití[editovat | editovat zdroj]
Fétizonovo činidlo bylo využito při několika totálních syntézách, například (±)-bukittingginu.[20]
Fétizonovo činidlo má využití i ve výzkumu sacharidů, kde slouží k selektivním oxidacím tri- a tetramethylovaných aldóz na aldolaktony,[21] oxidacím D-xylózy na D-threózu a L-arabinózy na L-erythrózu,[22] a L-sorbózy na L-threózu.[23]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Fétizon oxidation na anglické Wikipedii.
- ↑ a b Marcel Fétizon; Michel Golfier. Oxydation sélective des alcools par le carbonate d'argent. Comptes Rendus de l'Académie des Sciences, Série C. 1968, s. 900.
- ↑ a b FETIZON, M.; BALOGH, V.; GOLFIER, M. Oxidations with silver carbonate/celite. V. Oxidations of phenols and related compounds. The Journal of Organic Chemistry. 1971, s. 1339. DOI 10.1021/jo00809a004.
- ↑ PARRA, M. G. D. L.; HUTCHINSON, C. R. Macrolide biosynthesis: Stereochemistry of the hydroxylation of brefelding C. The Journal of Antibiotics. 1987, s. 1170–4. DOI 10.7164/antibiotics.40.1170. PMID 3680028.
- ↑ Tojo, Gabriel (2006) "Fétizon's reagent: Silver Carbonate on Celite." Oxidation of Alcohols to Aldehydes and Ketones. US: Springer. ISBN 978-0-387-23607-0 DOI:10.1007/0-387-25725-X_8 pp. 281–288.
- ↑ a b c KAKIS, F. J.; FETIZON, M.; DOUCHKINE, N.; GOLFIER, M.; MOURGUES, P.; PRANGE, T. Mechanistic studies regarding the oxidation of alcohols by silver carbonate on celite. The Journal of Organic Chemistry. 1974, s. 523. DOI 10.1021/jo00918a024.
- ↑ a b Eckert-Maksić, M.; TUŠEK, L.; SUNKO, D. E. Croat. Chim. Acta. 1971, s. 79.
- ↑ a b Terashima, Shiro; TANNO, NORIHIKO; KOGA, KENJI. A Novel Synthesis of (±)-2-acetyl-5,8-dimethoxy-1,2,3,4-tetrahydro-2-naphthol, a Key Intermediate for the Synthesis of Anthracyclinones. Tetrahedron Letters. 1980, s. 2749–2752. DOI 10.1016/S0040-4039(00)78596-0.
- ↑ a b c d FÉTIZON, M.; GOLFIER, M.; LOUIS, J. M. Highly selective oxidations of diols by silver carbonate. Journal of the Chemical Society D: Chemical Communications. 1969, s. 1102. DOI 10.1039/C29690001102.
- ↑ ZELLE, Robert E.; DENINNO, Michael P.; SELNICK, Harold G.; DANISHEFSKY, Samuel J. A Systematic Degradation of Zincophorin: A Stereoselective Synthesis of the C17-C25 Frament. The Journal of Organic Chemistry. 1986, s. 5032–5036. DOI 10.1021/jo00375a060.
- ↑ FÉTIZON, Marcel; GOLFIER, Michel; LOUIS, Jean-Marie. A New Synthesis of Lactones: Application to (±)-Mevalonolactone. Journal of the Chemical Society D. 1969, s. 1118–1119. DOI 10.1039/C29690001118.
- ↑ BUECHI, G.; WUEST, H. Synthesis of 2-acetyl-1,4,5,6-tetrahydropyridine, a constituent of bread aroma. The Journal of Organic Chemistry. 1971, s. 609. DOI 10.1021/jo00803a030.
- ↑ KHUONG-HUU, F.; HERLEM, D. Alcaloides steroidiques CX (1) - N-demethylation photochimique D'amines tertiaires steroidiques. Tetrahedron Letters. 1970, s. 3649–52. DOI 10.1016/S0040-4039(01)98552-1. PMID 5470892.
- ↑ GONIKBERG, E. M.; LE NOBLE, W. J. Face Selection in Reactions of 5,7-Diazaadamantan-2-one Derivatives: Mutual Influence of Remote Substituents. The Journal of Organic Chemistry. 1995, s. 7751. DOI 10.1021/jo00129a014.
- ↑ ROK LEE, Y.; KIM, B. S.; IL KWEON, H. Efficient Synthesis of Dihydrofuroquinolinones and Furoquinolinones by Silver(I)/Celite Promoted Oxidative Cycloaddition. Tetrahedron. 2000, s. 3867. DOI 10.1016/S0040-4020(00)00307-0.
- ↑ Mitchell, Ian S.; PATTENDEN, GERALD; STONEHOUSE, JEFFERY P. A concise enantioselective total synthesis of rhizoxin D. Tetrahedron Lett.. 2002, s. 493–497. DOI 10.1016/S0040-4039(01)02154-2.
- ↑ LENZ, G. R. Fragmentation reactions catalysed by Fétizon's reagent (silver carbonate on Celite). Journal of the Chemical Society, Chemical Communications. 1972, s. 468. DOI 10.1039/C39720000468.
- ↑ FETIZON, M.; GOLFIER, M.; MONTAUFIER, M. T.; RENS, J. Rearrangements des halohydrines en presence de carbonate d'argent sur celite-II. Tetrahedron. 1975, s. 987. DOI 10.1016/0040-4020(75)80114-1.
- ↑ THUAN, M. S. L. T.; MAITTE, M. P. Oxydation selective d'α diols aryl-ethyleniques en α-cetols. Tetrahedron Letters. 1975, s. 2027. DOI 10.1016/S0040-4039(00)75284-1.
- ↑ Thuan, S.-L.-T. Acad. Sc. Paris. 1971, s. 233.
- ↑ HEATHCOCK, C. H.; STAFFORD, J. A.; CLARK, D. L. Daphniphyllum alkaloids. 14. Total synthesis of (±)-bukittinggine. The Journal of Organic Chemistry. 1992, s. 2575. DOI 10.1021/jo00035a011.
- ↑ Morgenlie, Svein; LEANDER, Kurt; LÜNING, Björn; FÅHRAEUS, Gösta; LJUNGGREN, Hans; EHRENBERG, L. Oxidation of Carbohydrate Derivatives with Silver Carbonate on Celite. Oxidation of some Aldose Methyl Ethers. Acta Chemica Scandinavica. 1971, s. 1154–1155. DOI 10.3891/acta.chem.scand.25-1154.
- ↑ Morgenlie, Svein; LEHTO, Anneli; SIMOV, D.; ØYE, H. A.; SVENSSON, Sigfrid. Oxidation of Carbohydrate Derivatives with Silver Carbonate on Celite. III. Formation of Tetroses from D-Xylose and L-Arabinose. Acta Chemica Scandinavica. 1972, s. 1709–1710. DOI 10.3891/acta.chem.scand.26-1709.
- ↑ Morgenlie, Svein; SVENSSON, Sigfrid; SÆTHRE, Leif J.; ENZELL, Curt R.; SVENSSON, Sigfrid. Oxidation of Carbohydrate Derivatives with Silver Carbonate on Celite. IV. Oxidation of L-Sorbose, an Alternative Synthesis of L-Threose. Acta Chemica Scandinavica. 1972, s. 2146–2147. DOI 10.3891/acta.chem.scand.26-2146.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Fétizonova oxidace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fétizonova oxidace na Wikimedia Commons
