Buckminsterfulleren
| Buckminsterfulleren | |
|---|---|
 Strukturní vzorec | |
 Kuličkový model | |
| Obecné | |
| Systematický název | (C60−Ih)[5,6]fulleren |
| Anglický název | Buckminsterfullerene |
| Německý název | Buckminster-Fulleren |
| Sumární vzorec | C60 |
| Vzhled | tmavé jehlicové krystaly |
| Identifikace | |
| Registrační číslo CAS | 99685-96-8 |
| PubChem | 123591 |
| SMILES | c12c3c4c5c2c2c6c7c1c1c8c3c3c9c4c4c%10c5c5c2c2c6c6c%11c7c1c1c7c8c3c3c8c9c4c4c9c%10c5c5c2c2c6c6c%11c1c1c7c3c3c8c4c4c9c5c2c2c6c1c3c42 |
| InChI | 1S/C60/c1-2-5-6-3(1)8-12-10-4(1)9-11-7(2)17-21-13(5)23-24-14(6)22-18(8)28-20(12)30-26-16(10)15(9)25-29-19(11)27(17)37-41-31(21)33(23)43-44-34(24)32(22)42-38(28)48-40(30)46-36(26)35(25)45-39(29)47(37)55-49(41)51(43)57-52(44)50(42)56(48)59-54(46)53(45)58(55)60(57)59 |
| Vlastnosti | |
| Molární hmotnost | 720,660 g/mol |
| Hustota | 1,65 g.cm−3 |
| Rozpustnost ve vodě | nerozpustný |
Některá data mohou pocházet z datové položky. | |
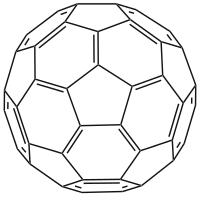
Buckminsterfulleren je fulleren se vzorcem C60. Je tvořen uzavřenou klecí ve tvaru komolého dvacetistěnu, skládá se z dvaceti šestiúhelníkových a dvanácti pětiúhelníkových stěn, tvarem připomíná fotbalový balon. Každý uhlík vytváří vazby ke třem okolním atomům uhlíku. Je to černá pevná látka rozpustná v uhlovodících za tvorby fialových roztoků. Tato sloučenina je intenzivně studována, i když zatím nemá praktickou aplikace.
Historie[editovat | editovat zdroj]
Japonský chemik Eiji Osawa v 70. letech teoreticky předpověděl existenci uhlíkových klastrů a také odhadl některé jejich vlastnosti.[1] V roce 1985 byly v hmotnostních spektrech grafitu odpařeného laserem objeveny píky odpovídající hmotnostem 720 a 840. Tyto hmotnosti odpovídají molekulám C60 a C70.
Etymologie[editovat | editovat zdroj]
Objevitelé tohoto alotropu ho pojmenovali po americkém architektovi Buckminster Fullerovi, který je autorem mnoha geodetických kopulí, podobných vzhledem molekule C60.[2] Zemřel v roce 1983, rok před objevem fullerenu.[3]
Výskyt[editovat | editovat zdroj]
Buckminsterfulleren je nejběžnější, přirozeně se vyskytující fulleren. Malá množství je možné nalézt v sazích.[4][5] Neutrální forma C60 byla nalezena v planetárních mlhovinách[6] a některých typech hvězd.[7] Ionizovaná forma, C +
60 , se nachází v mezihvězdném prostředí[8] a je původcem několika mezihvězdných absorpčních pásů.[9]
Syntéza[editovat | editovat zdroj]
Saze jsou produkovány laserovou ablací grafitu nebo pyrolýzou aromatických uhlovodíků. Fullereny jsou pak extrahovány organickými rozpouštědly pomocí Soxhletova extraktoru. Tímto krokem získáme roztok obsahující až 75 % C60 a také dalších fullerenů. Tyto frakce jsou pak separovány pomocí chromatografických metod, nejčastěji pomocí kolonové chromatografie.
Struktura[editovat | editovat zdroj]
Buckminsterfulleren má tvar komolého dvacetistěnu s 60 vrcholy a 32 stranami (20 šestiúhelníkových a 12 pětiúhelníkových, kdy žádné pětiúhelníky nesdílejí vrchol).[10] Van der Waalsův poloměr molekuly je okolo 0,55 nm. Poloměr měřený jako vzdálenost mezi jádry je pak 0,71 nm. Pozorujeme dva typy vazeb C–C, vazbu mezi uhlíky sdílenými šestiúhelníky (6–6) můžeme považovat za dvojnou a je kratší než vazba mezi uhlíky sdílenými šestiúhelníkem a pětiúhelníkem (6–5). Průměrná délka vazby je 0,14 nm. Každý atom uhlíku vytváří vazby ke třem dalším uhlíkům. Atom uhlíku v molekule C60 může být substituován atomem boru nebo dusíku, za vzniku C59B nebo C59N.
Vlastnosti[editovat | editovat zdroj]
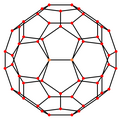
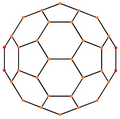
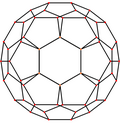
| Centrováno na | Vrchol | Hranu 5–6 |
Hranu 6–6 |
Šestiúhelníkovou stranu |
Pětiúhelníkovou stranu |
|---|---|---|---|---|---|
| Obrázek | 
|
|
|
|

|
| Četnost rotace |
[2] | [2] | [2] | [6] | [10] |
Rozpustnost[editovat | editovat zdroj]

Fullereny jsou nerozpustné ve vodě, ale dobře se rozpouštějí v aromatických rozpouštědlech a sirouhlíku. Roztoky C60 mají tmavě fialovou barvu, po odpaření vzniká hnědý zbytek. Krystalizací z některých rozpouštědel lze získat solváty, např. krystalizace z benzenu poskytuje trojklonné krystaly C60·4C6H6.[11]
Chemické reakce[editovat | editovat zdroj]
Redoxní[editovat | editovat zdroj]
C60 podléhá šesti reversibilním, jednoelektronovým redukcím, poskytujícím C 6-
60 . Oxidace je nevratná. Chová se jako elektronově deficitní alken, např. reaguje s nukleofily.[12]
Halogenace[editovat | editovat zdroj]
Fluor, chlor a brom se dokáží adovat na C60. Fluor je dostatečně malý, aby mohlo dojít k 1,2-adici, chlor a brom reagují 1,3- nebo 1,4-adicí. V závislosti na podmínkách reakce může docházet ke vzniku více různých derivátů. Navázání fluoru a chloru zpravidla vede ke zploštění klece C60.
Adice kyslíku[editovat | editovat zdroj]
Roztoky C60 lze oxidovat za vzniku epoxidu C60O. Ozonizace C60 v 1,2-xylenu poskytuje ozonid, C60O3, který se rozkládá. Termický rozklad vede ke vzniku epoxidu, zatímco fotolýzou vzniká kyslíkový můstek na 5,6-hraně.

Komplexy s kovy[editovat | editovat zdroj]
C60 vytváří komplexy podobné běžnějším alkenům. Byly popsány komplexy s molybdenem, wolframem, platinou, palladiem, iridiem a titanem. Fotochemickými reakcemi vznikají pentakarbonylové komplexy:
- M(CO)6 + C60 → M(η2-C60)(CO)5 + CO (M = Mo, W)
V případě komplexu s platinou vystupuje ethylenový ligand jako odstupující skupina v termické reakci:[13]
- Pt(η2-C2H4)(PPh3)2 + C60 → Pt(η2-C60)(PPh3)2 + C2H4
Byly popsány i komplexy s titanocenem:
- (η5-Cp)2Ti(η2-(CH3)3SiC≡CSi(CH3)3) + C60 → (η5-Cp)2Ti(η2-C60) + (CH3)3SiC≡CSi(CH3)3
Koordinačně nevysycené komplexy, jako např. Vaskův komplex, tvoří s C60 adukty:
- trans-Ir(CO)Cl(PPh3)2 + C60 → Ir(CO)Cl(η2-C60)(PPh3)2
Endohedrální fullereny[editovat | editovat zdroj]
Do fullerenové klece je možné uzavřít atomy kovu nebo malé molekuly, např. H2 nebo H2O. Endohedrální deriváty lze syntetizovat přídavkem kovu ke grafitu v obloukovém výboji. Složitější metodou je tzv. molekulová chirurgie, která umožňuje uzavření požadovaného atomu nebo molekuly do fullerenu pomocí sledu organických reakcí.[14]
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Buckminsterfullerene na anglické Wikipedii.
- ↑ Fullerene: Properties, Synthesis and Application
- ↑ UNIVERSITY, © Stanford; STANFORD; CALIFORNIA 94305. What is a geodesic dome?. R. Buckminster Fuller Collection - Spotlight at Stanford [online]. 2017-04-06 [cit. 2022-10-09]. Dostupné online. (anglicky)
- ↑ WEIL, Martin. R. Buckminster Fuller Dies at 87 of Heart Attack. Washington Post. 1983-07-03. Dostupné online [cit. 2022-10-09]. ISSN 0190-8286. (anglicky)
- ↑ HOWARD, Jack B.; LAFLEUR, Arthur L.; MAKAROVSKY, Yakov. Fullerenes synthesis in combustion. Carbon. 1992, roč. 30, čís. 8, s. 1183–1201. Dostupné online [cit. 2022-07-12]. DOI 10.1016/0008-6223(92)90061-Z. (anglicky)
- ↑ HOWARD, Jack B.; MCKINNON, J. Thomas; MAKAROVSKY, Yakov. Fullerenes C60 and C70 in flames. Nature. 1991-07, roč. 352, čís. 6331, s. 139–141. Dostupné online [cit. 2022-07-12]. ISSN 0028-0836. DOI 10.1038/352139a0. (anglicky)
- ↑ CAMI, Jan; BERNARD-SALAS, Jeronimo; PEETERS, Els. Detection of C 60 and C 70 in a Young Planetary Nebula. Science. 2010-09-03, roč. 329, čís. 5996, s. 1180–1182. Dostupné online [cit. 2022-07-12]. ISSN 0036-8075. DOI 10.1126/science.1192035. (anglicky)
- ↑ ROBERTS, Kyle R. G.; SMITH, Keith T.; SARRE, Peter J. Detection of C60 in embedded young stellar objects, a Herbig Ae/Be star and an unusual post-asymptotic giant branch star: C60 in young stellar and other objects. Monthly Notices of the Royal Astronomical Society. 2012-04-21, roč. 421, čís. 4, s. 3277–3285. Dostupné online [cit. 2022-07-12]. DOI 10.1111/j.1365-2966.2012.20552.x. (anglicky)
- ↑ BERNÉ, O.; MULAS, G.; JOBLIN, C. Interstellar C 60 +. Astronomy & Astrophysics. 2013-02, roč. 550, s. L4. Dostupné online [cit. 2022-07-12]. ISSN 0004-6361. DOI 10.1051/0004-6361/201220730.
- ↑ CAMPBELL, E. K.; HOLZ, M.; GERLICH, D. Laboratory confirmation of C60+ as the carrier of two diffuse interstellar bands. Nature. 2015-07, roč. 523, čís. 7560, s. 322–323. Dostupné online [cit. 2022-07-12]. ISSN 0028-0836. DOI 10.1038/nature14566. (anglicky)
- ↑ Nejkulatější molekula. vesmir.cz [online]. [cit. 2022-07-12]. Dostupné online.
- ↑ TALYZIN, Alexandr V. Phase Transition C 60 −C 60 *4C 6 H 6 in Liquid Benzene. The Journal of Physical Chemistry B. 1997-11-01, roč. 101, čís. 47, s. 9679–9681. Dostupné online [cit. 2022-09-24]. ISSN 1520-6106. DOI 10.1021/jp9720303. (anglicky)
- ↑ REED, Christopher A.; BOLSKAR, Robert D. Discrete Fulleride Anions and Fullerenium Cations. Chemical Reviews. 2000-03-01, roč. 100, čís. 3, s. 1075–1120. Dostupné online [cit. 2022-09-24]. ISSN 0009-2665. DOI 10.1021/cr980017o. (anglicky)
- ↑ KRAFT, Andreas; BEUERLE, Florian. Metal–organic hybrid architectures built from functionalized fullerenes and metal ions or clusters. Tetrahedron Letters. 2016-10, roč. 57, čís. 42, s. 4651–4663. Dostupné online [cit. 2022-10-07]. DOI 10.1016/j.tetlet.2016.08.082. (anglicky)
- ↑ MURATA, Michihisa; MURATA, Yasujiro; KOMATSU, Koichi. Surgery of fullerenes. Chemical Communications. 2008, čís. 46, s. 6083. Dostupné online [cit. 2022-09-24]. ISSN 1359-7345. DOI 10.1039/b811738a. (anglicky)
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Buckminsterfulleren na Wikimedia Commons
Obrázky, zvuky či videa k tématu Buckminsterfulleren na Wikimedia Commons
