Sukcinátdehydrogenáza
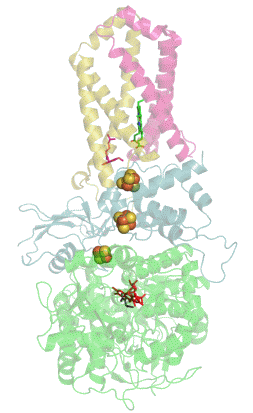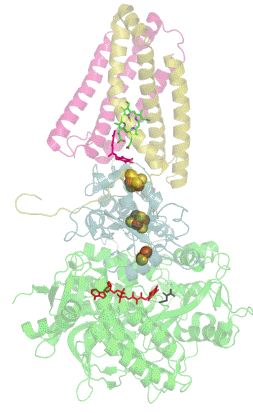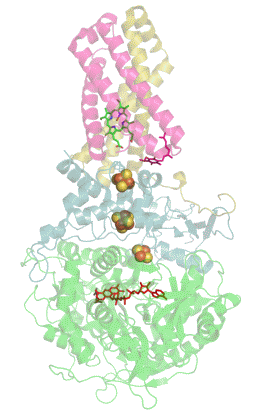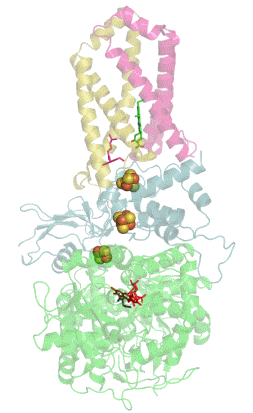
Sukcinát dehydrogenáza (SDH), též mitochondriální komplex II (CII) nebo sukcinát-ubichinon oxidoreduktáza (SQR) je enzymatický komplex přítomný v mitochondriích eukaryot a v bakteriálních buňkách. Tento komplex katalyzuje oxidaci sukcinátu na fumarát za současné redukce ubichinonu na ubichinol.[1] Sukcinát dehydrogenáza je tedy řazena mezi oxidoreduktázy. SDH ale zároveň dodává elektrony ze sukcinátu do elektron transportního řetězce. Díky tomu tvoří pomyslnou křižovatku mezi dvěma pro buňku nezbytnými energetickými procesy - citrátovým (Krebsovým) cyklem a dýchacím řetězcem. SDH je také jediným enzymem citrátového cyklu, který není volně v mitochondriální matrix, ale je ukotven ve vnitřní membráně mitochondrií.[2]
Struktura
[editovat | editovat zdroj]Sukcinát dehydrogenáza se skládá ze čtyř různých podjednotek označených jako SDHA, SDHB, SDHC a SDHD (Obrázek 1). Sestavený komplex obsahuje dvě morfologicky odlišné části - hydrofilní část tvořenou SDHA a SDHB, kde dochází k enzymatické aktivitě, a hydrofobní část z podjednotek SDHC a SDHD, která ukotvuje celý komplex ve vnitřní mitochondriální membráně.[3]
SDHA je flavoproteinem, obsahuje tedy kovalentně navázaný kofaktor flavin adenin dinukleotid (FAD), což je derivát vitamínu B2 (riboflavinu). Důležitým kofaktorem podjednotky SDHB jsou tři Fe-S klastry [2Fe-2S], [4Fe-4S] a [3Fe-4S]. SDHB spojuje katalytickou podjednotku SDHA s hydrofobní kotvou, která je tvořena z pojednotek SDHC a SDHD, mezi něž je vložena molekula hemu b, která zřejmě slouží ke stabilizaci (Obrázek 1).[4]
Kromě vazebného místo pro sukcinát (na podjednotce SDHA) obsahuje sukcinát dehydrogenáza hlavní vazebné místo pro ubichinon na pomezí podjednotek SDHB, SDHC a SDHD (Obrázek 1).
Skládání a maturace
[editovat | editovat zdroj]Všechny podjednotky sukcinát dehydrogenázy jsou kódovány v jaderném genomu, musí být tedy po translaci translokovány do mitochondriální matrix, kde dochází k poskládání celého komplexu. Na podjednotku SDHA je po přesunu do mitochondrie kovalentně navázán kofaktor FAD, k čemuž je zapotřebí dalšího proteinu - asemblačního faktoru sukcinát dehydrogenázy 2 - SDHAF2. Další asemblační faktor - SDHAF4 - chrání monomerní podjednotku SDHA a napomáhá jejímu spojení s SDHB.[4]
Do podjednotky SDHB jsou mitochondriálními proteinovými komplexy vloženy Fe-S klastry, které jsou ovšem náchylné na působení kyslíkových radikálů, dokud není celý komplex SDH poskládán. K její ochraně před radikály slouží další dva asemblační faktory - SDHAF1 a SDHAF3.[4] Žádný z výše zmíněných asemblačních faktorů ovšem není součástí maturované funkční SDH.
Nakonec je dimer SDHA-SDHB spojen s hydrofobními podjednotkami SDHC a SDHD, mezi něž je neznámým způsobem vložena molekula hemu b.
Mechanismus funkce
[editovat | editovat zdroj]
Enzymatická funkce sukcinát dehydrogenázy spočívá v katalýze oxidace sukcinátu a následném přenosu elektronů na molekulu ubichinonu (Obrázek 3). Molekula sukcinátu je vodíkovými vazbami stabilizována v aktivním místě podjednotky SDHA. Jeden z uhlíků molekuly sukcinátu je poté deprotonován a kofaktor FAD přijme hydrid z dalšího uhlíku molekuly. Tím ze sukcinátu vzniká fumarát a FAD je redukován na FADH2 (Obrázek 4).

Elektrony z molekuly FADH2 jsou poté přesouvány mezi jednotlivými Fe-S klastry podjednotky SDHB až do ubichinon vazebného místa. Poslední [3Fe-4S] klastr poté předává elektrony na ubichinon, který je redukován na ubichinol. Ten dále přenáší elektrony v rámci dýchacího řetězce.
Činnost enzymu je inhibována malonátem, který má totiž podobnou stavbu jako sukcinát a působí tak kompetitivně inhibičně.[2] Také oxalacetát má inhibiční účinky.[5]
Reference
[editovat | editovat zdroj]- ↑ Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- ↑ a b VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha: Victoria Publishing, 1995. ISBN 80-85605-44-9.
- ↑ Sun F, Huo X, Zhai Y, Wang A, Xu J, Su D, Bartlam M, Rao Z. Crystal Structure of Mitochondrial Respiratory Membrane Protein Complex II. Cell [online]. 1. 6. 2005 [cit. 31.8.2019]. Dostupné online. DOI 10.1016/j.cell.2005.05.025. PMID 15989954.
- ↑ a b c Van Vranken JG, Na U, Winge DR, Rutter J. Protein-mediated assembly of succinate dehydrogenase and its cofactors. Critical Reviews in Biochemistry and Molecular Biology [online]. 2015 [cit. 31.8.2019]. Dostupné online. DOI 10.3109/10409238.2014.990556. PMID 25488574.
- ↑ Robert K. Murray; Daryl K. Granner; Joe C. Davis; Peter A. Mayes; Victor W. Rodwell. Harper’s Illustrated Biochemistry; twenty-sixth edition. [s.l.]: [s.n.], 2003. ISBN 0-07-138901-6.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Sukcinátdehydrogenáza na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sukcinátdehydrogenáza na Wikimedia Commons
