Valin
| Valin | |
|---|---|
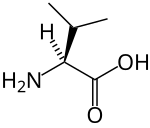 strukturní vzorec | |
| Obecné | |
| Systematický název | (2S)-2-amino-3-methylbutanová kyselina |
| Triviální název | Valin |
| Ostatní názvy | 2-aminoisovalerová kyselina |
| Funkční vzorec | HO2CCH(NH2)CH(CH3)2 |
| Sumární vzorec | C5H11NO2 |
| Vzhled | Bílá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 72-18-4 |
| Vlastnosti | |
| Molární hmotnost | 117,15 g/mol |
| Teplota tání | 315 °C |
| Teplota varu | ? °C |
| Hustota | 1,23 g/cm3 |
| Disociační konstanta pKa | 2,32 |
| Disociační konstanta pKb | 9,62 |
| Rozpustnost ve vodě | 8,8 g/100 ml (při 20 °C) |
| Rozpustnost v polárních rozpouštědlech | nerozpustný v acetonu a ethanolu |
| Izoelektrický bod | 5,97 |
| Průměrný výskyt | 6,0 % |
Některá data mohou pocházet z datové položky. | |
Valin (Val, V) je esenciální α-aminokyselina s nepolárním postranním řetězcem. Díky svému alifatickému postrannímu řetězci se řadí mezi hydrofobní aminokyseliny, a v proteinech je jeho hlavní rolí právě tvorba hydrofobních interakcí. Jeho kodóny jsou GUU, GUC, GUA, a GUG. Má stejný sumární vzorec jako dusitan amylnatý nebo nitropentan.
Historie[editovat | editovat zdroj]
Valin poprvé popsal von Gorup-Besanez roku 1856 při zkoumání žláz s vnitřní sekrecí, v proteinech byl identifikován Schützenbergerem, který zkoumal složení albuminu.[1] Své jméno získal podle isovalerové kyseliny, jíž je derivátem, která se hojně vyskytuje v kozlíku lékařském (Valeriana officinalis).
Funkce a vlastnosti[editovat | editovat zdroj]
Chemické vlastnosti[editovat | editovat zdroj]
Valin patří mezi hydrofobní aminokyseliny díky přítomnosti nereaktivní alifatické postranní skupiny. Má velmi podobné chemické vlastnosti jako leucin, oproti kterému je kratší o jednu methylovou skupinu, a spolu s isoleucinem tvoří skupinu aminokyselin s rozvětveným řetězcem.
Funkce v proteinech[editovat | editovat zdroj]
Valin se pro svůj hydrofobní charakter vyskytuje především zabořený uvnitř proteinů, kde zprostředkovává hydrofobní interakce. Je málo reaktivní a většinou se proto neúčastní enzymatických reakcí. Ve většině hydrofobních interakcí může být snadno nahrazen jinými hydrofobními aminokyselinami (leucinem nebo isoleucinem), ale vzhledem k tomu, že je větvený na svém β-uhlíku (podobně jako isoleucin a threonin), tedy blízko peptidické kostry, ovšem omezuje konformační volnost, nepodporuje například konformaci alfa-helix.[2]
Význam preference valinu pro výskyt uvnitř proteinů a ne na jejich povrchu ilustruje příklad srpkovité anémie, při které je mutován gen pro beta-hemoglobin. Dochází k ní při záměně hydrofilní kyseliny glutamové na pozici 6., která leží na povrchu proteinu, za hydrofobní valin. Mutovaná forma hemoglobinu má v odkysličeném prostředí tendenci shlukovat se díky hydrofóbním interakcím mezi jednotlivými molekulami hemoglobinu, protože tím se valin na pozici 6 "schová" mezi interagující proteiny, tedy mimo přítomnost vodného prostředí, takové shlukování hemoglobinu ovšem vede k poškození červené krvinky.
Jako doplněk stravy[editovat | editovat zdroj]
Jedním z oblíbených doplňků stravy v kulturistice je směs aminokyselin s rozvětveným řetězcem (BCAA) tedy leucin:isoleucin:valin nejčastěji v poměru 2:1:1. I když hlavní efekt pro růst svalové hmoty má leucin, přidání leucinu samotného snižuje koncentraci ostatních aminokyselin s rozvětveným řetězcem v krevní plasmě, proto musí být dodávány spolu s ním. I když dodávání BCAA má v krátkodobém horizontu pozitivní účinky, doposud (k 2014) neexistují dlouhodobé studie určující dlouhodobé bezpečné a efektivní dávky.[3]
Chemická syntéza[editovat | editovat zdroj]
Racemický valin lze syntetizovat bromací< kyseliny isovalerové, následovanou aminací[4]
- HO2CCH2CH(CH3)2 + Br2 → HO2CCHBrCH(CH3)2 + HBr
- HO2CCHBrCH(CH3)2 + 2 NH3 → HO2CCH(NH2)CH(CH3)2 + NH4Br
Zdroje[editovat | editovat zdroj]
Zdrojem valinu jsou kozí sýry, rybí maso, čočka, drůbež aj.
Metabolismus[editovat | editovat zdroj]
Valin je spolu s dalšími aminokyselinami s rozvětveným řetězcem odbouráván ve svalech, tukové tkáni, ledvinách a mozku, kde slouží jako zdroj energie, a ne v játrech, jak je běžné pro ostatní aminokyseliny. Za degradaci je zodpovědný dehydrogenázový komplex 2-ketokyselin s větveným řetězcem (BCKDC), pomocí sedmi metabolických reakcí je valin přeměněn na sukcinylkoenzym A, který vstupuje do citrátového cyklu, mechanismus degradace je podobný beta-oxidaci mastných kyselin.[5]
Při dědičné nemoci javorového sirupu (neboli leucinóze) nemá tělo funkční komplex rozkládající aminokyseliny s rozvětveným řetězcem (BCKDC), tedy i valin, takže při příjmu potravin bohatých na proteiny a při hladovění (kdy se odbourávají proteiny) se v těle hromadí toxické meziprodukty, jejichž projevem je zápach moči připomínající javorový sirup (případně karamel nebo sušené hrušky). Bez léčby je nemoc smrtelná, léčba spočívá v dietě limitující příjem proteinů, hlavně leucinu, isoleucinu a valinu.[6]
Mezi další metabolická onemocnění s poruchou odbourávání valinu patří methylmalonová acidémie, kombinovaná malonová a methylmalonová acidurie a propionová acidémie.
Reference[editovat | editovat zdroj]
- ↑ VICKERY, Hubert. The History of the Discovery of the Amino Acids. Chemical reviews. 1931, roč. 9, čís. 2, s. 169–318.
- ↑ BARNES, Michael R. Bioinformatics for Geneticists: A Bioinformatics Primer for the Analysis of Genetic Data. [s.l.]: Wiley, 2007. 576 s. ISBN 978-0470026205. Kapitola 14: Amino Acid Properties and Consequences of Substitutions, s. en. (anglicky)
- ↑ HELMS, ER.; ARAGON, AA.; FITSCHEN, PJ. Evidence-based recommendations for natural bodybuilding contest preparation: nutrition and supplementation.. J Int Soc Sports Nutr. 2014, roč. 11, s. 20. Dostupné online. DOI 10.1186/1550-2783-11-20. PMID 24864135.
- ↑ Marvel, C. S. “d,l-Valine” Organic Syntheses, Collected Volume 3, p.848 (1955). http://www.orgsyn.org/orgsyn/pdfs/CV3P0848.pdf Archivováno 30. 9. 2007 na Wayback Machine.
- ↑ NELSON, David L.; COX, Michael M. Lehninger Principles of Biochemistry. [s.l.]: W.H. Freeman, 2013. Dostupné online. ISBN 978-1429234146. Kapitola 18: Amino Acid Oxidation and the Production of Urea. (anglicky)
- ↑ Leucinóza (MSUD) [online]. novorozeneckyscreening.cz [cit. 2014-12-31]. Dostupné online.
Literatura[editovat | editovat zdroj]
- WHITFORD, David. Proteins: Structure and Function. 1.. vyd. [s.l.]: Wiley, 2005. 542 s. Dostupné online. ISBN 978-0471498940. Kapitola 2. Amino acids: the building blocks of proteins, s. 44–45. (anglicky)
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu valin na Wikimedia Commons
Obrázky, zvuky či videa k tématu valin na Wikimedia Commons - www.mzcr.cz
- www.mzcr.cz
- Isoleucine and valine biosynthesis
