Vakcína proti chřipce
Vakcíny proti chřipce, také známé jako chřipkové injekce, jsou vakcíny chránící před infekcí chřipkovými viry.[1] Nové verze vakcín se vyvíjejí dvakrát ročně, protože virus chřipky se rychle mění.[1] Protože je účinnost vakcín každý rok jiná, liší se také to, jakou poskytují úroveň ochrany proti chřipce.[1][2] Americká Centra pro kontrolu a prevenci nemocí odhadují, že očkování proti chřipce snižuje nemocnost, častost návštěv lékaře a počet hospitalizací a úmrtí.[3][4] Očkovaní pracovníci, kteří onemocní chřipkou, se v průměru vrátí do práce o půl dne dříve.[5] Účinnost vakcíny u osob starších 65 let zůstává nejistá kvůli nedostatku kvalitních dat.[6][7] Očkování dětí může chránit jejich okolí[1] a jejich opakované sezónní očkování je lépe chrání i do budoucna.[8]
Očkování proti chřipce začalo ve 30. letech 20. století; ve Spojených státech bylo velkoplošně dostupné od roku 1945.[9][10] Je na seznamu základních léků Světové zdravotnické organizace.[11]
Světová zdravotnická organizace a americká Centra pro kontrolu a prevenci nemocí doporučují každoroční očkování téměř všem osobám starším šesti měsíců, zejména vysoce rizikovým skupinám.[12][13][14] Evropské středisko pro prevenci a kontrolu nemocí rovněž doporučuje každoroční očkování vysoce ohrožených skupin,[15] jimiž jsou myšleny zejména těhotné ženy, senioři, děti od šesti měsíců do pěti let a osoby s některými konkrétními zdravotními problémy.[1][14]
Vakcíny se obecně považují za bezpečné; mezi nežádoucí účinky patří horečka (pět až deset procent očkovaných dětí), mohou se objevit dočasné bolesti svalů nebo pocit únavy. V některých letech byl vakcíně přičítán zvýšený výskyt Guillain-Barrého syndromu u starších lidí (přibližně jeden případ na milion dávek). Ačkoli se většina chřipkových vakcín vyrábí za pomoci vaječných bílkovin, stále se považují za bezpečné pro osoby trpící těžkou alergií na vejce;[16] u takto postižených jedinců nebylo prokázáno žádné zvýšené riziko alergické reakce na vakcíny na bázi vajec.[17] V USA začaly být vakcíny vyráběné jinými technologiemi, zejména rekombinantní vakcíny a vakcíny založené na buněčné kultuře, dostupné od roku 2012,[18] v Evropě[19] a Austrálii[17] o něco později. Vakcíny se nedoporučují lidem, u nichž předchozí očkování proti chřipce vyvolalo těžkou alergii.[1][16] Vakcína je k dostání v neaktivní a oslabené virové formě. Živá oslabená vakcína se obecně nedoporučuje těhotným ženám, dětem mladším dvou let, dospělým starším 50 let nebo lidem s oslabeným imunitním systémem.[1] V závislosti na typu mohou být vpraveny do svalu nebo do střední vrstvy kůže (intradermální) nebo nastříkány do nosu.[1] Intradermální vakcína nebyla dostupná během chřipkové sezóny 2018–2019 a 2019–2020.[20][21][22]
Dějiny[editovat | editovat zdroj]
Vakcíny jsou určeny jak lidem, tak zvířatům. Lidská vakcína je ta vakcína, která není stanovena jako veterinární, drůbeží nebo hospodářská.
Vznik a vývoj[editovat | editovat zdroj]
Při celosvětové pandemii španělské chřipky v roce 1918 „lékárníci vyzkoušeli všechno, co znali, všechno, o čem kdy slyšeli, od starověkého umění pouštění žilou přes podávání kyslíku až po vývoj nových vakcín a krevních sér (především proti tomu, co dnes nazýváme Haemophilus influenzae – bakterie původně považovaná za příčinu nemoci – a proti několika typům pneumokoků). Pouze jedno terapeutické opatření, transfuze krve od uzdravených pacientů podaná nově nakaženým, vykázalo jakýsi náznak úspěchu.“[23]
V roce 1931 Ernest William Goodpasture a jeho kolegové z Vanderbilt University zaznamenali růst virů v embryonovaných slepičích vejcích. Svou práci rozšířili vědci Thomas Francis, Jonas Salk, Wilson Smith a Macfarlane Burnet na růst viru chřipky; to vedlo ke vzniku prvních experimentálních vakcín.[24] Ve 40. letech 20. století vyvinula americká armáda první schválené neaktivní vakcíny, které se používaly ve druhé světové válce.[25] Slepičí vejce i nadále sloužila k výrobě viru pro chřipkové vakcíny, ale výrobcům se podařilo zdokonalit výrobní procesy, dosáhnout tak větší čistoty viru díky odstranění vaječných proteinů a snížit systémovou reaktivitu vakcíny.[26] V roce 2012 americký Úřad pro kontrolu potravin a léčiv schválil vakcíny proti chřipce vyrobené pěstováním viru v buněčných kulturách[27][28][29] a dále vakcíny vyrobené z rekombinantních proteinů.[30] Chřipkové vakcíny založené na rostlinné bázi jsou předmětem klinických studií.[31]
Ohlas[editovat | editovat zdroj]

Technologie výroby vakcíny proti chřipce pomocí vajec vznikla v 50. letech minulého století.[32] V roce 1976 byl prezident Gerald Ford nucen čelit hrozící pandemii prasečí chřipky v USA. Očkovací program byl překotný, přesto ho provázela zpoždění a problémy s veřejností. Za velkého nasazení se ozbrojeným silám podařilo nečekaně zajistit, aby se nový kmen nešířil mimo armádní základnu, kde vznikl. Na této základně několik vojáků těžce onemocnělo, ale pouze jeden zemřel. Program byl zrušen po naočkování asi 24 % populace. Odhaduje se, že v důsledku samotného očkovacího programu došlo k překročení počtu 25 úmrtí oproti normálním ročním úrovním, jakož i ke čtyřem stovkám nadměrných hospitalizací v důsledku Guillain-Barrého syndromu. To dokazuje, že samotná vakcína není bez rizik. Výsledek je argumentem pro přetrvávající pochybnosti o očkování a vyvrací nepodložená tvrzení o bezpečnosti očkování.[33] Nakonec však i tato škodlivá vakcína z roku 1976 možná zachránila některé životy. Výsledky studie z roku 2010 zjistily zvýšenou imunitní odpověď při pandemii H1N1 z roku 2009 u těch účastníků studie, kteří byli očkováni proti prasečí chřipce v roce 1976.[34]
Quadrivalentní vakcíny proti sezónní chřipce[editovat | editovat zdroj]
Quadrivalentní vakcína proti chřipce podávaná nosním sprejem byla schválena Úřadem pro kontrolu potravin a léčiv v březnu 2012;[35][36] Fluarix Quadrivalent v prosinci 2012.[37]
V roce 2014 zveřejnil Kanadský národní poradní výbor pro imunizaci přehled čtyřvalentních vakcín proti chřipce.[38]
Počínaje chřipkovou sezónou 2018–2019 je většina očkování proti chřipce na bázi vajec a všechny rekombinantní a buněčné vakcíny ve Spojených státech čtyřvalentní.[39] V chřipkové sezóně 2019–2020 byly všechny běžné dávky chřipkových injekcí a všechny rekombinantní chřipkové vakcíny ve Spojených státech čtyřvalentní.[40]
V listopadu 2019 FDA schválila Fluzone High-Dose Quadrivalent pro použití ve Spojených státech počínaje chřipkovou sezónou 2020–2021.[41][42]
V únoru 2020 FDA schválila Fluad Quadrivalent pro použití ve Spojených státech.[43][44] V červenci 2020 schválila FDA jak Fluad, tak Fluad Quadrivalent pro použití ve Spojených státech pro chřipkovou sezónu 2020–2021.[43][45]
Lékařské použití[editovat | editovat zdroj]
Americká Centra pro kontrolu a prevenci nemocí (CKPN) doporučují vakcínu jako nejlepší způsob, jak lidi chránit před chřipkou a bránit jejímu šíření.[46] Vakcína může snížit závažnost chřipky i v případě nákazy kmenem, který neobsahovala.[46] Po očkování trvá přibližně dva týdny, než se vytvoří ochranné protilátky.[46][47]
Podle metaanalýzy z roku 2012 bylo očkování proti chřipce účinné 67 procent sledovaného času; populace, která z toho měla největší prospěch, byli HIV pozitivní dospělí ve věku 18 až 55 let (76 procent), zdraví dospělí ve věku 18 až 46 let (přibližně 70 procent) a zdravé děti ve věku od 6 měsíců do 24 měsíců (66 procent).[48] Vakcína zřejmě rovněž chrání před infarktem myokardu s přínosem 15 až 45 %.[49]
Účinnost[editovat | editovat zdroj]
| 2004 | 10 % |
|---|---|
| 2005 | 21 % |
| 2006 | 52 % |
| 2007 | 37 % |
| 2008 | 41 % |
| 2009 | 56 % |
| 2010 | 60 % |
| 2011 | 47 % |
| 2012 | 49 % |
| 2013 | 52 % |
| 2014 | 19 % |
| 2015 | 48 % |
| 2016 | 40 % |
| 2017 | 38 % |
| 2018 | 29 % |
| 2019 | 39 % |
Vakcína se posuzuje podle své účinnosti – podle toho, do jaké míry snižuje riziko onemocnění za kontrolovaných podmínek – a podle efektivnosti – nakolik snižuje riziko chřipky v běžném provozu.[54] V případě chřipky se očekává, že efektivnost bude nižší než účinnost, protože se do jejího měření započítávají i onemocnění podobná chřipce, ta však nemusejí být vždy způsobena virem chřipky.[5] Vakcíny obecně vykazují vysokou účinnost, měřenou produkcí protilátek na zvířecích modelech nebo očkovaných lidech.[55] V reálném světě je však obtížné provádět studie o účinnosti vakcín; vakcíny mohou být nedokonale spárované, prevalence viru se v jednotlivých letech značně liší a chřipka je často zaměňována s jinými onemocněními jí podobnými.[56] Většinu let (16 z 19 let před rokem 2007) však kmeny vakcíny proti chřipce dobře odpovídaly cirkulujícím kmenům,[57] a dokonce i nevhodná vakcína často poskytne zkříženou ochranu.[46] Virus se rychle mění v důsledku antigenního driftu, lehké mutace ve viru, která způsobí vznik nového kmene.[58]
Opakované každoroční očkování obecně nabízí stálou meziroční ochranu proti chřipce.[59] Existující důkazy však nasvědčují tomu, že opakované očkování může způsobit snížení účinnosti vakcíny u určitých podtypů chřipky; to nemá žádný význam pro současná doporučení každoročního očkování, ale může to ovlivnit budoucí očkovací politiku.[60][61] Od roku 2019 CKPN doporučují každoroční očkování, protože většina studií prokazuje celkovou účinnost každoročního očkování proti chřipce.[59]
Covid-19[editovat | editovat zdroj]
Očkování proti chřipce nezabrání onemocnění covid-19, ale ochrání před nákazou chřipkou ve stejnou dobu s covidem-19; taková kombinace výrazně zvyšuje riziko závažnosti onemocnění. Podle dosavadních dat je u pacientů napadených těmito dvěma viry více než dvakrát vyšší pravděpodobnost úmrtí než u pacientů pouze s covidem-19. Pacienti, kteří se uzdravili z covidu-19, se mohou bez obav nechat očkovat proti chřipce. Vakcína proti chřipce a vakcína proti covidu-19 mohou být podány současně.[47][62]
Kritika[editovat | editovat zdroj]
Tom Jefferson, který vedl hodnocení vakcín proti chřipce Cochrane Collaboration, nazval klinické důkazy týkající se vakcín proti chřipce „zbytečnostmi“, a proto je prohlásil za neprůkazné; vyzval k placebem kontrolovaným randomizovaným klinickým studiím, které většina v oboru považuje za neetické. Jeho názory na účinnost vakcín proti chřipce odmítají lékařské instituce včetně CKPN a National Institutes of Health a klíčové osobnosti v oboru jako Anthony Fauci.[63]
Michael Osterholm, který vedl hodnocení vakcín proti chřipce Centra pro výzkum a politiku infekčních chorob roku 2012, očkování doporučil, ale kritizoval jeho propagaci slovy: „Tuto vakcínu jsme příliš protežovali a přeháněli ohledně ní... nechrání tak, jak tvrdí reklama. Všechno je to práce prodeje: všechno jsou to vztahy s veřejností.“[64]
Děti[editovat | editovat zdroj]
Centrum pro kontrolu a prevenci nemocí doporučuje, aby všichni kromě kojenců mladších šesti měsíců dostali vakcínu proti sezónní chřipce.[12] Očkovací kampaně obvykle věnují zvláštní pozornost osobám s rizikem závažných komplikací v případě infekce chřipkou, tj. těhotným ženám, dětem do 59 měsíců, starším lidem a lidem s chronickým onemocněním nebo oslabeným imunitním systémem; stejně tak těm, kdo jsou ve styku s nakaženými, tj. zdravotníkům.[12][65]
Vzhledem k tomu, že úmrtnost u kojenců nakažených chřipkou je vysoká, CKPN a Světová zdravotnická organizace doporučují očkování osobám v domácnostech s kojenci a pečovatelům o kojence, aby se tím snížilo riziko přenosu.[65][66]
Zdá se, že vakcína snižuje u dětí riziko chřipky, případně onemocnění chřipce podobných.[67] Pro děti mladší dvou let se potýkáme s nedostatkem dat.[67] Ředitel CDC uvedl během chřipkové sezóny 2017–18, že 85 procent dětí, které zemřely, „pravděpodobně nebylo očkováno“.[68]
Ve Spojených státech CDC od ledna 2019 doporučuje, aby děti ve věku od 6 do 35 měsíců dostávaly buď 0,25 mililitru nebo 0,5 mililitru přípravku Fluzone Quadrivalent.[40][69] Pro tuto věkovou skupinu nezáleží na objemu dávky Fluzone Quadrivalent.[40] Všechny osoby ve věku 36 měsíců a starší by měly dostat 0,5 mililitru Fluzone Quadrivalent.[40] Od října 2018 je ve Spojených státech licencován přípravek Afluria Quadrivalent pro děti ve věku 6 měsíců a starší.[40][70] Dávka pro děti od šesti měsíců do 35 měsíců věku je stanovena na 0,25 mililitru Afluria Quadrivalent,[40] všechny děti ve věku 36 měsíců a starší by měly dostat 0,5 mililitru.[40] Od února 2018 je v Kanadě licencována Afluria Tetra pro dospělé a děti od pěti let.[71]
V roce 2014 publikoval kanadský Národní poradní výbor pro imunizaci (NACI) přehled očkování proti chřipce u zdravých 5–18letých[72] a v roce 2015 přehled používání pediatrického přípravku Fluad u dětí ve věku 6–72 měsíců věku.[73] Jedna studie provedená v terciárním referenčním centru uvádí míru očkování u dětí pouze 31 %. Vyšší výskyt byl zjištěn u dětských pacientů s potlačenou imunitou (46 %) a u pacientů se zánětlivým onemocněním střev (50 %).[74]
Dospělí[editovat | editovat zdroj]

Šestnáct procent neočkovaných dospělých má příznaky podobné chřipce, zatímco u očkovaných je to jen deset procent.[5] Očkování snížilo počet potvrzených případů chřipky z přibližně 2,4 % na 1,1 %.[5] Očkování nemá vliv na hospitalizaci.[5]
Zpráva Cochrane Collaboration uvádí, že u pracujících dospělých vedlo očkování k mírnému snížení jak příznaků chřipky, tak ztrát pracovních dnů, aniž by to ovlivnilo přenos nebo komplikace související s chřipkou.[5] U zdravých pracujících mohou vakcíny proti chřipce poskytnout střední ochranu proti virologicky potvrzené chřipce, i když tato ochrana je v některých sezónách značně snížena nebo zcela chybí.[6]
U zdravotníků uvádí zpráva z roku 2006 čistý přínos.[75] Z osmnácti studií v tomto shrnutí pouze dvě posuzovaly také vztah úmrtnosti pacientů a míry očkování zdravotníků; obě došly k závěru, že vyšší míra očkování zdravotníků vedla ke snížené úmrtnosti pacientů.[75] Souhrn z roku 2014 vykazuje přínos pro pacienty, jejichž ošetřující zdravotnický personál byl očkován, a uvádí přiměřené důkazy[76] částečně založené na pozorovaném snížení úmrtí ze všech příčin u pacientů, jejichž ošetřující personál byl očkován, ve srovnání s pacienty, kdy personál očkovaný nebyl.[77]
Starší osoby[editovat | editovat zdroj]
Důkazy o účinnosti u dospělých nad 65 let nejsou prokazatelné.[78] Soustavná přezkoumávání vycházející z výsledků jak randomizovaných kontrolovaných studií, tak studií případové kontroly nenalezly dostatek přesvědčivých důkazů.[6][7] Revize případových a kontrolních studií poukázaly na účinky proti laboratorně potvrzené chřipce, zápalu plic a úmrtí u starších lidí žijících společně.[79][80]
Starší lidé, skupina nejvíce ohrožená nepandemickou chřipkou, má z vakcíny nejmenší prospěch. Za tímto strmým poklesem účinnosti vakcín stojí několik důvodů, z nichž nejčastější jsou klesající imunologické funkce a křehkost spojená s pokročilým věkem.[81] V nepandemickém roce má ve Spojených státech osoba ve věku 50–64 let téměř desetkrát vyšší pravděpodobnost úmrtí na chřipku než osoba mladší; lidé starší 65 let jsou desetkrát víc ohroženi úmrtím v důsledku chřipky než lidé věkové skupiny 50–64 let.[82]
Existuje vysokodávková vakcína formulovaná tak, aby poskytovala silnější imunitní odpověď.[83] Dostupné důkazy naznačují, že očkování starších osob vysokodávkovou vakcínou vede k silnější imunitní odpovědi proti chřipce než očkování vakcínou s běžnou dávkou.[84][85][86]
Vakcína proti chřipce obsahující adjuvans byla schválena americkým Úřadem pro kontrolu potravin a léčiv v listopadu 2015 pro použití dospělými ve věku 65 let a staršími. Vakcína se v USA prodává pod názvem Fluad a poprvé byla dostupná v chřipkové sezóně 2016–2017. Vakcína obsahuje adjuvans MF59C.1,[87] což je emulze skvalenového oleje ve vodě. Je to první vakcína proti sezónní chřipce s adjuvans prodávaná ve Spojených státech.[88][89][90] Není jasné, zda použití vakcíny proti chřipce obsahující adjuvans MF59C.1 má pro starší osoby významný přínos.[91][92][93] Podle pokynů Poradního výboru pro imunizační postupy lze Fluad použít jako alternativu k jiným vakcínám proti chřipce schváleným pro osoby ve věku 65 let a starší.[89]
Očkování zdravotnických pracovníků, kteří pracují se staršími lidmi, se doporučuje v mnoha zemích s cílem snížit počet případů chřipky u této zranitelné populace.[94][95][96] I když neexistují žádné přesvědčivé důkazy z randomizovaných klinických studií, že očkování zdravotníků pomáhá chránit starší lidi před chřipkou, existují předběžné důkazy o přínosu.[97]
Fluad Quad byl schválen pro použití v Austrálii v září 2019,[98] Fluad Quadrivalent pro použití ve Spojených státech v únoru 2020[43] a Fluad Tetra pro použití v Evropské unii v květnu 2020.[99]
Těhotenství[editovat | editovat zdroj]
Kromě ochrany matky a dítěte před účinky chřipkové infekce zvyšuje imunizace těhotných žen jejich šance úspěšně donosit dítě.[100]
Trivalentní inaktivovaná vakcína proti chřipce chrání těhotné ženy infikované HIV.[101]
Bezpečnost[editovat | editovat zdroj]
Nežádoucí účinky[editovat | editovat zdroj]
I když se mohou vyskytnout nežádoucí účinky vakcíny proti chřipce, jsou obvykle mírné a zahrnují především bolestivost, zarudnutí a otok v místě vpichu, bolesti hlavy, horečky, nevolnost nebo únavu.[102]
Nežádoucí účinky vakcíny podávané jako nosní sprej mohou zahrnovat rýmu, sípání, bolest v krku, kašel nebo zvracení.[103]
U některých lidí může chřipková vakcína vzácně způsobit závažné vedlejší účinky, včetně alergické reakce. Kromě toho, běžné vedlejší účinky a rizika očkování jsou mírné a dočasné ve srovnání s riziky a závažnými zdravotními následky každoroční epidemie chřipky.[46]
Guillain-Barrého syndrom[editovat | editovat zdroj]
Ačkoli byl syndrom Guillain-Barrého obávanou komplikací očkování, CKPN uvádí, že většina studií o moderních vakcínách proti chřipce nepozorovala žádnou souvislost s Guillain-Barré.[104][105] Srovnáme-li infekci virem chřipky a očkování, pak infekce sama o sobě zvyšuje jak riziko úmrtí (až jedno z deseti tisíc), tak riziko rozvoje Guillain-Barrého syndrom mnohem víc (podle odhadů z roku 2009 přibližně desetkrát víc).[106][107]
Jedna zpráva uvádí výskyt přibližně jednoho případu Guillain–Barré na milion očkování,[108] avšak rozsáhlá studie v Číně (zahrnující téměř sto milionů dávek vakcíny proti „prasečí“ chřipce H1N1 z roku 2009) zjistila pouze jedenáct případů Guillain-Barrého syndromu (0,1 na milion dávek) z celkového výskytu u očkovaných osob (ve skutečnosti nižší, než je normální míra onemocnění v Číně), a žádné další závažné vedlejší účinky.[107][109]
Alergie na vejce[editovat | editovat zdroj]

I když se většina vakcín proti chřipce vyrábí technikami s využitím vajec, přesto se stále doporučují lidem s alergií na vejce, a to i se závažnou.[16] Studie zkoumající bezpečnost podání vakcíny těžkým alergikům zjistily, že anafylaxe je velmi vzácná a vyskytuje se v 1,3 případu na milion podaných dávek.[16]
U pacientů se závažnějším průběhem se doporučuje sledování příznaků po očkování.[110] Studie s téměř 800 dětmi s alergií na vejce, včetně více než 250 s předchozími anafylaktickými reakcemi, vykazovala nulové systémové alergické reakce při podání živé oslabené vakcíny.[111][112]
Jiné[editovat | editovat zdroj]
Několik studií poukázalo na zvýšený výskyt narkolepsie u příjemců pandemické vakcíny proti chřipce H1N1 s adjuvans ASO3.[113] Nabízí se vysvětlení, že narkolepsie je autoimunitní a že vakcína H1N1 s adjuvans ASO3 může napodobovat hypocretin, který funguje jako spouštěč.[114]
Některé injekční vakcíny proti chřipce určené pro dospělé ve Spojených státech obsahují thiomersal (také známý jako thimerosal), konzervační látku na bázi rtuti.[115][116] Navzdory určitým sporům v médiích[117] však Globální poradní výbor pro bezpečnost vakcín Světové zdravotnické organizace dospěl k závěru, že neexistují žádné důkazy o toxicitě thiomersalu ve vakcínách, a není nutné z bezpečnostních důvodů přecházet na dražší jednorázové vakcíny.[118]
Typy[editovat | editovat zdroj]
Vakcíny proti chřipce jsou dostupné buď jako:
- trivalentní nebo quadrivalentní vnitrosvalová injekce (IIV3, IIV4 nebo RIV4, tedy TIV nebo QIV), která obsahuje inaktivovanou formu viru;
- nosní sprej živé atenuované vakcíny proti chřipce (LAIV, Q/LAIV), která obsahuje živou, ale oslabenou formu viru.
TIV nebo QIV vyvolávají ochranu po injekci (typicky vnitrosvalová, i když injekce do kůže a pod kůži mohou být také ochranné)[119] na základě imunitní odpovědi na antigeny přítomné na inaktivovaném viru. Naproti tomu LAIV přizpůsobený k odolnosti proti chladu, působí tak, že vyvolá imunitní reakci v nosní dutině.[120]
Doporučení[editovat | editovat zdroj]
Různé organizace veřejného zdraví, včetně Světové zdravotnické organizace (WHO), doporučují poskytovat běžně každoroční očkování zejména lidem s rizikem komplikací chřipky a těm, kdo žijí s vysoce rizikovými jedinci nebo se o ně starají, jmenovitě:
- lidé ve věku 50 let nebo starší[14]
- lidé s chronickými plicními chorobami, včetně astmatu[14]
- lidé s chronickými srdečními chorobami[14]
- lidé s chronickým onemocněním jater[14]
- lidé s chronickým onemocněním ledvin[14]
- lidé, kterým byla odstraněna slezina nebo jejichž slezina nefunguje správně
- lidé s oslabenou imunitou[14]
- obyvatelé pečovatelských domů a dalších zařízení dlouhodobé péče[14]
- zdravotníci (jak k prevenci nemoci, tak k prevenci šíření na pacienty)[121][122]
- ženy, které jsou nebo budou těhotné během chřipkové sezóny[14]
- děti a dospívající (ve věku od 6 měsíců do 18 let), kteří dostávají léky obsahující kyselinu acetylsalicylovou nebo salicylát a kteří mohou být vystaveni riziku vzniku Reyeova syndromu po infekci virem chřipky[14]
- američtí indiáni/domorodci z Aljašky[14]
- lidé, kteří jsou morbidně obézní (index tělesné hmotnosti ≥40 u dospělých)[14]
Vakcína proti chřipce se nedoporučuje osobám mladším šesti měsíců a osobám se závažnými, život ohrožujícími alergiemi na tuto vakcínu nebo kteroukoli její složku.[12][123][16]
Světová zdravotnická organizace[editovat | editovat zdroj]
Světová zdravotnická organizace (WHO) doporučuje od roku 2016 sezónní očkování pro:[124][125][125][125][126]
První priorita:
- Těhotné ženy
Druhá priorita (bez konkrétního pořadí):
- Děti ve věku 6–59 měsíců
- Starší osoby
- Jedinci s některými konkrétními chronickými zdravotními stavy
- Zdravotníci
Kanada[editovat | editovat zdroj]
Národní poradní výbor pro imunizaci (NACI), skupina, která radí Kanadské agentuře veřejného zdraví, doporučuje, aby každá osoba starší šesti měsíců byla vyzvána ke každoročnímu očkování proti chřipce a aby děti ve věku od 6 do 24 měsíců a jejich kontakty v domácnosti, měly vysokou prioritu, pokud jde o vakcínu.[127]
Zejména:
- Lidé s vysokým rizikem hospitalizace nebo komplikací souvisejících s chřipkou, morbidně obézních osob, zdravých těhotných žen, dětí ve věku 6–59 měsíců, starších osob, původních obyvatel a lidí trpících některým z chronických zdravotních stavů uvedených na seznamu
- Osoby schopné přenést chřipku na vysoce rizikové osoby, včetně kontaktů v domácnostech a včetně zdravotnických pracovníků
- Lidé, kteří poskytují základní komunitní služby
- Určití pracovníci s drůbeží
Živá oslabená vakcína proti chřipce (LAIV) nebyla v Kanadě pro sezónu 2019–2020 dostupná.[127]
Evropská unie[editovat | editovat zdroj]
Evropské centrum pro prevenci a kontrolu nemocí (ECDC) doporučuje přednostně očkovat seniory, na druhém místě pak osoby s chronickým onemocněním a zdravotnické pracovníky.[128]
Strategie očkování proti chřipce obecně spočívá v ochraně zranitelných lidí spíše než v omezování cirkulace chřipky nebo v úplném odstranění chřipkového onemocnění u lidí. To je v kontrastu se strategiemi velkoplošné imunizace u jiných infekčních chorob, jako je obrna a spalničky.[129] Částečně je to způsobeno také finanční a logistickou zátěží spojenou s každoroční potřebou injekce.[130]
Spojené státy[editovat | editovat zdroj]

Ve Spojených státech se očkování proti chřipce běžně doporučuje všem osobám ve věku od šesti měsíců.[14][131] Po očkování trvá až dva týdny, než se v těle vytvoří dostatečné množství protilátek.[131] CDC doporučuje očkovat se do konce října,[14] ačkoliv v prosinci nebo později to považuje rovněž za vhodné.[14][46][131]
Podle CDC by se některé skupiny měly vyhýbat živému oslabenému viru (LAIV4) (který se v USA vyskytuje ve formě nosního spreje).[14][132]
CDC, které začalo vakcínu proti chřipce doporučovat zdravotníkům v roce 1981, zdůrazňuje v rámci celoplošného doporučení lékařům ve Spojených státech nutnost očkovat zvláště jedince ze zranitelných skupin a jejich pečovatele:
- Očkování je důležité zejména pro lidi s vyšším rizikem závažných komplikací při chřipce nebo osoby, které žijí s jedinci s vyšším rizikem závažných komplikací nebo se o ně starají.[133] V roce 2009 byla schválena nová vysokodávková formulace standardní vakcíny proti chřipce.[134] Fluzone High Dose je určena pro osoby ve věku 65 let a starší; rozdíl je v tom, že má čtyřikrát větší dávku antigenu než standardní Fluzone.[134][135][136][137]
Americká vláda požaduje, aby nemocnice hlásily míru proočkovanosti pracovníků. Některé státy USA a stovky amerických nemocnic vyžadují, aby zdravotníci během chřipkové sezóny buď byli očkováni, nebo nosili roušky. Tyto požadavky občas vyústí v soudní pře s odbory, ale obhájci poznamenávají, že soudy obecně schválily zákony o nuceném očkování, které se vztahují na širokou populaci během propuknutí onemocnění.[138]
Očkování proti chřipce je považováno za důležité zejména pro vysoce ohrožené skupiny, u nichž by chřipka mohla vést ke zdravotním komplikacím, například pro těhotné ženy[14][139] a děti a dospívající ve věku od šesti měsíců do 18 let, kteří užívají kyselinu acetylsalicylovou nebo léky obsahující salicyláty a u nichž se předpokládá riziko vzniku Reyeova syndromu po infekci chřipkovým virem.[14]
- Cílem zvýšení horní věkové hranice na 18 let je jednak zkrátit čas, který děti a rodiče ztrácejí návštěvami u pediatra a zameškanou školní docházkou, jednak snížit potřebu antibiotik kvůli komplikacím[140]
- Dalším přínosem očekávaným od očkování dětí je snížení počtu případů chřipky mezi rodiči a ostatními členy domácnosti a možného šíření do širokého okolí[140]
CDC uvedlo, že živá oslabená vakcína proti chřipce (LAIV), nazývaná také nosní sprejová vakcína, nebyla pro chřipkovou sezónu 2016–2017 ve Spojených státech doporučena.[141]
Kromě toho CDC doporučuje, aby zdravotnický personál, který se stará o osoby se silně oslabenou imunitou, dostával injekce (TIV nebo QIV) spíše než LAIV.[142]
Spojené království[editovat | editovat zdroj]
Doktorka Jenny Harries zastává názor, že zima 2021–2022 ve Spojeném království bude nejistá, protože chřipka a covid-19 se poprvé vyskytnou společně. Vyzvala způsobilé osoby, aby se nechaly očkovat proti covidu-19 a chřipce. Doktorka tvrdí, že očkování proti chřipce je důležité každý rok. Lidé se musí dozvědět, že chřipka může být smrtelná, protože mnoho lidí to neví.[143]
Austrálie[editovat | editovat zdroj]
Australská vláda doporučuje očkování proti sezónní chřipce pro všechny osoby starší šesti měsíců. Austrálie používá inaktivované vakcíny.[144] Do roku 2021 byla jediná dostupná vakcína na bázi vajec (ta je nadále jedinou bezplatnou vakcínou), ale od března 2021 je k dispozici nová vakcína na bázi buněk pro ty, kdo si ji chtějí zaplatit; očekává se, že do roku 2026 se stane standardem.[17] Standardní vakcína proti chřipce je zdarma pro následující osoby:[145]
- děti ve věku od šesti měsíců do pěti let;
- osoby ve věku 65 let a více;
- domorodci a obyvatelé ostrova Torres Strait ve věku šesti měsíců a více;
- těhotné ženy;
- kdokoli starší šesti měsíců se zdravotními problémy, které mohou vést ke komplikacím v případě chřipky, jako je těžké astma, plicní nebo srdeční onemocnění, nízká imunita nebo cukrovka.
Příjem[editovat | editovat zdroj]
| Země | Region | % ve věku 65+ |
|---|---|---|
| Jižní Korea | Asie | 83 |
| Austrálie | Oceánie | 75 |
| Spojené království | Evropa | 73 |
| Spojené státy | Amerika | 68 |
| Nový Zéland | Oceánie | 65 |
| Chile | Amerika | 65 |
| Holandsko | Evropa | 64 |
| Kanada | Amerika | 61 |
| Portugalsko | Evropa | 61 |
| Izrael | Asie | 58 |
| Irsko | Evropa | 58 |
| Španělsko | Evropa | 54 |
| Itálie | Evropa | 53 |
| Dánsko | Evropa | 52 |
| Japonsko | Asie | 50 |
| Francie | Evropa | 50 |
| Švédsko | Evropa | 49 |
| Finsko | Evropa | 48 |
| Island | Evropa | 45 |
| Lucembursko | Evropa | 38 |
| Německo | Evropa | 35 |
| Norsko | Evropa | 34 |
| Maďarsko | Evropa | 27 |
| Česká republika | Evropa | 20 |
| Litva | Evropa | 13 |
| Slovenská republika | Evropa | 13 |
| Slovinsko | Evropa | 12 |
| Lotyšsko | Evropa | 8 |
| Turecko | Asie | 7 |
| Estonsko | Evropa | 5 |
U rizikových skupin[editovat | editovat zdroj]
Využití možnosti očkování proti chřipce jak sezónně, tak během pandemie je často nízké.[147] Analýzy očkování proti pandemické chřipce určily několik faktorů, které mohou očkování ovlivnit, a to včetně pohlaví (vyšší příjem u mužů), etnického původu (vyšší u lidí z etnických menšin) a chronického onemocnění.[148][149] Důležitá je také důvěra v bezpečnost a účinnost vakcíny.[147]
Bylo zjištěno, že ke zvýšení míry proočkovanosti u osob starších šedesáti let je užitečná řada opatření, jako: upomínání pacientů pomocí letáků a dopisů, upomínání formou pohlednic, programy pro klienty, návštěvy očkovacích domů, skupinové očkování, bezplatné očkování, platby lékařem, upomínky od lékaře a podpora soutěžení lékařů.[150]
Zdravotníci[editovat | editovat zdroj]
Pracovníkům v přední linii se často doporučuje očkování proti sezónní a jakékoli pandemické chřipce. Například ve Spojeném království je všem zdravotnickým pracovníkům zapojeným do péče o pacienty doporučeno, aby přijali vakcínu proti sezónní chřipce, a také jim bylo doporučeno nechat se očkovat proti H1N1/09 (později přejmenováno na A(H1N1)pdm09[note 1][151]), viru prasečí chřipky z období pandemie v roce 2009. Ochota nechat se očkovat je však často nízká.[122] Během pandemie v roce 2009 se v zemích Spojeného království,[122] Itálie,[152] Řecka[153] a Hongkongu[154] nechal očkovat nízký počet zdravotníků.
Během průzkumu ve Spojených státech v roce 2010 uvedlo 63,5 % zdravotníků, že dostali vakcínu proti chřipce během sezóny 2010–11, což je nárůst oproti původním 61,9 % v předchozí sezóně. Američtí zdravotníci s přímým kontaktem s pacienty měli vyšší míru očkování: lékaři a zubní lékaři 84,2 % a zdravotní sestry 82,6 %.[155][156][157]
Hlavním důvodem očkování zdravotnických pracovníků je zabránit tomu, aby personál šířil chřipku na své pacienty, a snížit výpadek personálu v době vysoké poptávky po službách; avšak důvody, které zdravotničtí pracovníci uvádějí pro své rozhodnutí přijmout nebo odmítnout očkování, mají častěji co do činění s vnímáním osobních výhod.[122]
Ve veřejných nemocnicích státu Victoria (Austrálie) se v roce 2005 pohybovala míra očkování zdravotnických pracovníků od 34 % u neklinického personálu po 42 % u laboratorního personálu. Jedním z důvodů odmítnutí vakcín byly obavy z nežádoucích účinků; 31 % lékařů fakultní nemocnice v jedné studii nesprávně věřilo, že australské vakcíny mohou způsobit chřipku.[158]
Výroba[editovat | editovat zdroj]

Pokračuje výzkum v duchu „univerzální“ vakcíny proti chřipce, která by nevyžadovala přizpůsobení konkrétnímu kmeni, ale účinkovala by proti široké škále chřipkových virů.[159] Do listopadu 2007 však nebyli oznámeni žádní kandidáti na takovou vakcínu.[160]
Ve zprávě z roku 2007 byla celosvětová kapacita přibližně 826 milionů dávek vakcíny proti sezónní chřipce (inaktivované a živé), což byl dvojnásobek skutečné produkce 413 milionů dávek. Podle krizového scénáře výroby vakcín proti pandemické chřipce do roku 2013 by mohlo být vyrobeno pouze 2,8 miliardy vakcín v šestiměsíčním časovém rámci. Pokud by všechny země s vysokými a vyššími středními příjmy poptávaly vakcíny pro celou svou populaci během pandemie, bylo by zapotřebí téměř dvou miliard vakcín. Pokud by Čína sledovala tento cíl také, bylo by zapotřebí více než tří miliard vakcín, které by sloužily její populaci.[161] Výzkum a vývoj vakcín pokračuje s cílem vytvořit nové postupy, které by zajistily produkci mnohem většího množství vakcín za cenu dostupnou pro globální populaci.
Na bázi vajec[editovat | editovat zdroj]
Většinu vakcín proti chřipce pěstují výrobci vakcín v oplozených slepičích vejcích.[162][160] Na severní polokouli začíná výrobní proces poté, co WHO oznámí (obvykle v únoru) seznam doporučených kmenů pro zimní chřipkovou sezónu.[162][163] Vyberou se tři kmeny chřipky (představující kmen H1N1, H3N2 a B) a slepičí vejce se naočkují odděleně. Tyto monovalentní sklizně se pak spojí, a vznikne trivalentní vakcína.[164]
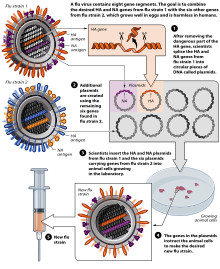
Od listopadu 2007 jsou jak běžné vakcíny, tak nosní spreje vyráběny s použitím slepičích vajec. Evropská unie rovněž schválila Optaflu, vakcínu, kterou firma Novartis vyrábí za použití živočišných buněk. Očekává se, že tato technika bude časem převažovat a předejde se tak problémům s vejci, jako jsou alergické reakce a neslučitelnost kmenů, která postihuje ptáky, jako například kuřata.[160]
Vakcíny proti chřipce se vyrábějí ve vejcích bez choroboplodných zárodků, která jsou jedenáct nebo dvanáct dní stará.[165] Vršek vejce se dezinfikuje alkoholem a poté se vejce zapálí, aby se určila nežilná oblast v alantoidní dutině; zde je vypálen malý otvor, sloužící k uvolnění tlaku.[166] Druhý otvor se vytvoří v horní části vajíčka, kudy je chřipkový virus vpraven přes chorioalantoickou membránu do alantoidní dutiny. Oba otvory se poté utěsní roztaveným parafínem a naočkovaná vejce se inkubují 48 hodin při 37 stupních Celsia.[165] Během inkubační doby se virus množí a nově replikované viry se uvolňují do alantoidní tekutiny.[167]
Po 48hodinové inkubační době se vršek vajíčka rozbije a nabere se deset mililitrů alantoidní tekutiny, z níž se získá asi patnáct mikrogramů vakcíny proti chřipce. V tomto okamžiku jsou viry oslabeny nebo usmrceny a virový antigen je purifikován a umístěn do lahviček, injekčních stříkaček nebo nosních sprejů.[167] Tato metoda se provádí ve velkém měřítku a používá se k výrobě chřipkové vakcíny pro lidskou populaci.
Jiné způsoby výroby[editovat | editovat zdroj]
Vakcíny lze vyrábět i jinými způsoby, například pomocí částic podobných chřipkovému viru (VLP). VLP se podobají virům, ale není potřeba potlačovat jejich aktivitu, protože neobsahují virové kódující částice, ale pouze prezentují antigeny podobným způsobem jako virion. VLP lze vyrábět v kulturách buněk hmyzu Spodoptera frugiperda Sf9 a nebo na rostlinné bázi (např. produkcí v Nicotiana benthamiana). Existují důkazy, že některé VLP vyvolávají vznik protilátek, které rozpoznávají širší panel antigenně odlišných virových izolátů ve srovnání s jinými vakcínami v testu hemaglutinace-inhibice (HIA).[168]
DNA vakcína na bázi genu, která se používá k aktivaci imunitního systému inaktivovanou vakcínou H5N1, prošla klinickými testy v roce 2011.[169][170][171]
Dne 20. listopadu 2012 obdržel Novartis schválení FDA pro první vakcínu s buněčnou kulturou.[172][173]Dne 20. listopadu 2012 obdržel Novartis schválení FDA pro první vakcínu s buněčnou kulturou.[172][173] V roce 2013 byla rekombinantní vakcína proti chřipce, Flublok, schválena pro použití ve Spojených státech.[174][175][176] V roce 2013 byla rekombinantní vakcína proti chřipce, Flublok, schválena pro použití ve Spojených státech.[174][175][176]
Dne 17. září 2020 přijal Výbor pro humánní léčivé přípravky (CHMP) Evropské lékové agentury (EMA) kladné stanovisko doporučující udělení registrace pro Supemtek, čtyřvalentní vakcínu proti chřipce (rekombinantní, připravenou v buněčné kultuře).[177] Žadatelem o tento léčivý přípravek je Sanofi Pasteur.[177] Supemtek byl schválen pro lékařské použití v Evropské unii v listopadu 2020.[19]
Austrálie schválila svou první buněčnou vakcínu, založenou na „věčné buněčné linii“ psí ledviny, v březnu 2021. Vzhledem ke způsobu výroby produkuje vakcínu lépe přizpůsobenou chřipkovým kmenům.[17]
Efektivita nákladů[editovat | editovat zdroj]
Efektivita nákladů na očkování proti sezónní chřipce byla široce hodnocena pro různé skupiny a v různých prostředích.[177] U starších osob (nad 65 let) většina publikovaných studií zjistila, že očkování šetří náklady, přičemž úspory nákladů spojené s očkováním proti chřipce (např. omezení návštěv zdravotní péče) převažují nad náklady na očkování.[178] Několik publikovaných studií uvádí, že očkování proti chřipce u starších dospělých (ve věku 50–64 let) je pravděpodobně nákladově efektivní, nicméně bylo zjištěno, že výsledky těchto studií často závisejí na klíčových předpokladech použitých v ekonomických hodnoceních.[179] Nejistotu v modelech nákladové efektivity chřipky lze částečně vysvětlit složitostí odhadu zátěže onemocněním[180] a také sezónní variabilitou cirkulujících kmenů a shodou vakcíny.[181][182] Studie z roku 2012 došla k závěru, že u zdravých pracujících (ve věku 18–49 let) očkování obecně nešetří náklady, přičemž vhodnost financování závisí na ochotě zaplatit za získání souvisejících zdravotních výhod.[183] U dětí většina studií zjistila, že očkování proti chřipce bylo nákladově efektivní, avšak mnoho studií zahrnovalo (nepřímé) zvýšení produktivity, kterému nemusí být ve všech prostředích přikládána stejná váha.[184] Několik studií se pokusilo předpovědět nákladovou efektivitu zásahů (včetně prepandemického očkování), které by pomohly chránit před budoucí pandemií, nicméně odhad nákladové efektivity byl komplikován nejistotou ohledně závažnosti potenciální budoucí pandemie a účinnosti zavedených opatření.[185]
Výzkum[editovat | editovat zdroj]
Výzkum chřipky zahrnuje molekulární virologii, molekulární evoluci, patogenezi, imunitní reakce hostitele, genomiku a epidemiologii. Ty pomáhají při vývoji protichřipkových opatření, jako jsou vakcíny, terapie a diagnostické nástroje. Zlepšení opatření proti chřipce vyžaduje základní výzkum toho, jak viry vstupují do buněk, replikují se, mutují, vyvíjejí se do nových kmenů a vyvolávají imunitní odpověď. Projekt sekvenování genomu chřipky vytváří knihovnu sekvencí chřipky,[186] která výzkumníkům pomůže pochopit, proč je jeden kmen smrtelnější než jiný, jaké genetické určující faktory nejvíce ovlivňují imunogenicitu a jak se virus v průběhu času vyvíjí. Zkoumají se řešení omezení současných očkovacích metod.
Jiný přístup využívá internetový obsah k odhadu dopadu očkovací kampaně. Přesněji řečeno, výzkumníci použili data z Twitteru a vyhledávače Bing společnosti Microsoft a navrhli statistický rámec, který řadou operací převádí tyto informace na odhady procenta snížení počtu onemocnění podobných chřipce v oblastech, kde bylo provedeno očkování. Metoda byla použita k vyhodnocení dopadu dvou programů očkování proti chřipce v Anglii (2013/14 a 2014/15), kde byla dětem školního věku podána živá oslabená vakcína proti chřipce (LAIV). Je pozoruhodné, že odhady dopadu se téměř shodovaly s odhady společnosti Veřejného zdraví Anglie (Public Health England), které vycházely ze sledování tradičních parametrů onemocnění.[187][188]
Rychlá reakce na pandemickou chřipku[editovat | editovat zdroj]
Rychlý vývoj, výroba a distribuce vakcín proti pandemické chřipce by výhledově mohly během pandemie chřipky zachránit miliony životů. Vzhledem ke krátkému časovému odstupu mezi určením pandemického kmene a potřebou očkování hledají vědci nové technologie pro výrobu vakcín, které by mohly poskytnout lepší přístup v reálném čase a byly by vyráběny levněji. Tím by se zlepšil přístup k vakcínám pro lidi žijící v chudých oblastech a zemích se středními příjmy, kde může pandemie chřipky pravděpodobně vzniknout. Těmito technologiemi jsou myšleny technologie živých oslabených virů (na bázi vajec nebo buněk) a rekombinantní technologie (proteiny a částice podobné virům).[189] Od července 2009 bylo dokončeno nebo probíhá více než sedmdesát známých klinických studií s vakcínami proti pandemické chřipce.[190] V září 2009 FDA schválila čtyři vakcíny proti chřipkovému viru 2009 H1N1 (pandemický kmen z roku 2009) a očekává se, že první šarže vakcíny budou dostupné během následujícího měsíce.[191]
V lednu 2020 schválil americký Úřad pro kontrolu potravin a léčiv (FDA) produkt Audenz jako vakcínu proti chřipkovému viru H5N1.[192] Audenz určený k aktivní imunizaci a prevenci onemocnění způsobeného subtypem viru chřipky A H5N1 je schválen pro použití u osob ve věku 6 měsíců a starších, které jsou ohroženy virem chřipky A podtypu H5N1 obsaženým ve vakcíně.[193]
Univerzální vakcíny proti chřipce[editovat | editovat zdroj]
„Univerzální vakcína“, navržená bez nutnosti každoročně vyvíjet novou kombinaci chřipkových virů pro každou sezónu na každé polokouli, by pomohla stabilizovat zásoby, odstraňovat chyby při předpovídání variant sezóny a chránit před únikem cirkulujících kmenů mutací.[159] Taková vakcína je předmětem výzkumu po celá desetiletí.[194]
Jedním z přístupů je použití široce neutralizujících protilátek. Zatímco každoroční sezónní vakcíny používané v prvních desetiletích 21. století nutí tělo k imunitní reakci, neutralizační protilátky poskytují část imunitní reakce. První neutralizační protilátky byly rozpoznány v roce 1993 při experimentech.[195] Zjistilo se, že chřipkové neutralizační protilátky se navázaly na stopku proteinu hemaglutinin. Byly rozpoznány protilátky, které se mohly vázat na hlavu těchto proteinů. Vysoce konzervovaný protonový kanál M2 byl navržen jako možný cíl pro široce neutralizující protilátky.[194][196]
Výzvou pro výzkumníky je určit jednotlivé protilátky, které by mohly neutralizovat mnoho podtypů viru tak, aby byly použitelné v jakékoli sezóně; vázaly by se na konzervované domény, odolné vůči antigennímu driftu.[194]
Dalším přístupem je vzít konzervované domény z těchto projektů a dodat skupiny odpovídajících antigenů k vyvolání imunitní reakce; předmětem výzkumu jsou různé přístupy s rozdílnými antigeny, podávanými odlišnými způsoby (jako fúzní proteiny upevněné na částicích podobných virům, na nepatogenních virech, jako DNA a další).[196][197][198]
Bylo také vynaloženo úsilí na vývoj univerzálních vakcín, které specificky aktivují odpověď T-lymfocytů; klinická data ukazují, že lidé se silnou, časnou odpovědí T-buněk mají lepší výsledky po nákaze chřipkou, protože T-buňky reagují na konzervované epitopy. Výzvou pro vývojáře je, že tyto epitopy se nacházejí na vnitřních proteinových doménách, které jsou jen mírně imunogenní.[196]
Lidé pracující na univerzálních vakcínách experimentují spolu se zbytkem vakcinační oblasti s adjuvans, aby zlepšili schopnost vakcín vytvořit dostatečně silnou a trvalou imunitní odpověď.[196] [199]
Proběhly některé klinické testy univerzálních kandidátů na vakcínu proti chřipce[200][201][159][202][203] a od srpna 2020 je všech 7 zkoušek M-001 dokončeno. Každá z těchto studií vedla k závěru, že M-001 je bezpečný, snesitelný a imunogenní. Stěžejní studie fáze III s 12 400 účastníky byla dokončena a výsledky analýzy dat zveřejněné v říjnu 2020 naznačují, že vakcína nevykazuje žádný statistický rozdíl ve srovnání se skupinou s placebem ve snížení počtu případů chřipkového onemocnění a závažnosti.[204][205][205]
Perorální vakcína proti chřipce[editovat | editovat zdroj]
Od roku 2019 byla předmětem klinického výzkumu ústně podávaná vakcína proti chřipce.[206] Kandidát na perorální vakcínu je založen na vektoru adenoviru typu 5 upraveném tak, že došlo k odstranění genů potřebných pro replikaci a k přidání genu, který exprimuje malou dvouvláknovou vlásenkovou molekulu RNA jako adjuvans.[207] Klinická studie fáze II z roku 2020 ukázala, že perorální forma vakcíny byla lidmi dobře snášena a poskytovala podobnou imunitu jako licencovaná injekční vakcína.[208]
Veterinární použití[editovat | editovat zdroj]
Veterinární očkování proti chřipce má za cíl dosáhnout následujících čtyř cílů:[209]
- Ochrana před klinickým onemocněním
- Ochrana před infekcí virulentním virem
- Ochrana před vylučováním virů
- Sérologické odlišení nakažených a očkovaných zvířat (tzv. princip DIVA)
Koně[editovat | editovat zdroj]
Koňská chřipka vyvolává horečku, suchý dráždivý kašel, rýmu, depresi, nechuť jíst a pít po dobu několika dní; obvykle se však koně uzdraví do dvou až tří týdnů. „Očkovací schémata obecně vyžadují primární kúru dvou dávek v odstupu 3–6 týdnů, po nichž následují přeočkování v půlročních až ročních intervalech. Obecně se uznává, že v mnoha případech taková schémata nemusí udržet chránící hladiny protilátek a ve vysoce rizikových situacích se doporučuje častější podávání.“[210]
Na výstavách ve Spojeném království je běžným standardem očkování proti koňské chřipce a musí být předložen očkovací průkaz; Mezinárodní federace jezdeckých sportů (FEI) vyžaduje očkování každých šest měsíců.[211][212]
Drůbež[editovat | editovat zdroj]
Drůbeží vakcíny proti ptačí chřipce jsou vyráběny levně, bez nutnosti filtrování a čištění od zbytků bakterií nebo od jiných virů, jako je to obvyklé u lidských vakcín. Obvykle obsahují celý virus, nejen hemaglutinin jako ve většině lidských vakcín. Další rozdíl je ten, že imunitní reakce na vakcíny pro drůbež je zesílena minerálním olejem, který však může způsobit zánět a abscesy. „Očkovatelům kuřat, kteří se omylem píchli, bolestivě otekly prsty, nebo dokonce došlo ke ztrátě palce,“ uvedli lékaři. Účinnost může být také omezená. Kuřecí vakcíny jsou často jen mlhavě podobné cirkulujícím kmenům chřipky – některé obsahují kmen H5N2 izolovaný před lety v Mexiku. „Když u kuřete použijete vakcínu, která je podobná pouze z 85 procent, získáte ochranu,“ řekl doktor Cardona. „U lidí můžete získat jedinou bodovou mutaci, a vakcína, která je podobná z 99,99 procent, vás neochrání.“ A jsou slabší [než lidské vakcíny]. „Kuřata jsou menší a musíte je chránit pouze šest týdnů, protože tak dlouho žijí, dokud je nesníte,“ řekl Dr. John J. Treanor, odborník na vakcíny z University of Rochester. Lidské vakcíny proti sezónní chřipce obsahují asi 45 mikrogramů antigenu, zatímco experimentální vakcína A(H5N1)) obsahuje 180 mikrogramů. Kuřecí vakcíny mohou obsahovat méně než jeden mikrogram. „Musíte být opatrní při extrapolaci dat z drůbeže na člověka,“ varoval Dr. David E. Swayne, ředitel oddělení zemědělství Southeast Poultry Research Laboratory. „Ptáci jsou blíže příbuzní dinosaurům.“[213]
Výzkumníci pod vedením Nicholase Savilla z University of Edinburgh ve Skotsku použili matematické modely, aby napodobili šíření viru H5N1, a dospěli k závěru, že „musí být chráněno nejméně 95 procent ptáků, aby se zabránilo tichému šíření viru. V praxi je obtížné chránit více než 90 procent hejna; úrovně ochrany dosažené vakcínou jsou obvykle mnohem nižší než tato.“[214] Organizace OSN pro výživu a zemědělství vydala doporučení k ochraně a kontrole ptačí chřipky u drůbeže, včetně použití očkování.[215]
Vyvíjí se filtrovaná a purifikovaná vakcína proti chřipce A pro lidi a mnoho zemí doporučilo, aby byly vytvořeny zásoby, takže pokud pandemie ptačí chřipky přeskočí na lidi, vakcína může být rychle podána, aby se předešlo ztrátám na životech. Angličtina má dva další názvy pro ptačí chřipku (‚avian flu‘ a ‚bird flu‘).[216]
Prasata[editovat | editovat zdroj]
Vakcíny proti prasečí chřipce jsou široce používány v chovu prasat v Evropě a Severní Americe. Většina těchto vakcín zahrnuje kmeny H1N1 a H3N2.
Prasečí chřipka byla uznána jako hlavní problém od jejího propuknutí v roce 1976. Evoluce viru vedla k proměnlivým reakcím na tradiční vakcíny. Standardní komerční vakcíny proti prasečí chřipce jsou účinné v případě, kdy se virové kmeny shodují natolik, že mají významnou zkříženou ochranu. Přizpůsobené (autogenní) vakcíny vyrobené ze specifických izolovaných virů jsou vyráběny a používány ve složitějších případech.[217] Výrobce vakcín Novartis tvrdí, že kmen H3N2 (poprvé zaznamenaný v roce 1998) přinesl chovatelům prasat velké ztráty. Běžným znakem jsou prudké potraty, kdy prasnice přestanou na několik dní žrát a mají vysokou horečku. Úmrtnost může být až patnáct procent.[218]
Psi[editovat | editovat zdroj]
V roce 2004 bylo objeveno, že virus chřipky A, podtyp H3N8, způsobuje chřipku u psů. Kvůli nedostatku předchozí expozice tomuto viru nemají psi přirozenou imunitu. Nicméně, v roce 2004 byla vynalezena vakcína.[219]
Každoroční přeformulování[editovat | editovat zdroj]
Světový systém sledování chřipky a reakce na ni, který funguje při WHO, vybírá každoročně tři kmeny pro očkování proti chřipce v daném roce.[220] Vybrané jsou kmeny H1N1, H3N2 a Type-B, o kterých se předpokládá, že v nadcházející sezóně s největší pravděpodobností způsobí lidem značné utrpení. Počínaje chřipkovou sezónou na severní polokouli v letech 2012–2013 (související se schválením čtyřvalentních vakcín proti chřipce) WHO také doporučila pro použití ve čtyřvalentních vakcínách druhý kmen B. Světová zdravotnická organizace každý rok uvádí v soulad složení vakcíny tak, aby obsahovaly ty kmeny viru, které nejpravděpodobněji zaútočí v příštím roce.
- „Globální síť pro sledování chřipky WHO“ byla založena v roce 1952 [v roce 2011 přejmenována na „Globální systém sledování chřipky a reakce na ni“].[221] Síť zahrnuje čtyři spolupracující centra WHO (WHO CC) a 112 institucí v 83 zemích, které jsou WHO uznávány jako WHO Národní Chřipková Centra (NIC). Tyto NIC odebírají vzorky ve své zemi, provádějí primární izolaci viru a předběžnou antigenní charakterizaci. Nově izolované kmeny zasílají do WHO CC pro antigenní a genetické analýzy na vysoké úrovni, jejichž výsledek tvoří každý rok základ pro doporučení WHO o složení chřipkové vakcíny pro severní a jižní polokouli.“[222]
Výběr virů pro proces výroby vakcíny „Globálním systémem sledování chřipky a reakce na ni“ je založen na jeho nejlepším odhadu, které kmeny budou v příštím roce převládat, což se nakonec rovná dobře informovaným, ale omylným odhadům.[223]
Formální doporučení WHO byla poprvé vydána v roce 1973. Počínaje rokem 1999 se vydávají dvě doporučení ročně: jedno pro severní polokouli a druhé pro jižní polokouli.[224]
Historické každoroční změny složení vakcíny proti chřipce jsou uvedeny v samostatném článku. Nedávná doporučení WHO pro složení vakcíny proti sezónní chřipce:
2017–2018 chřipková sezóna na severní polokouli[editovat | editovat zdroj]
Složení trivalentních virových vakcín pro použití v chřipkové sezóně na severní polokouli 2017–2018 doporučené Poradním výborem pro imunizační praktiky dne 25. srpna 2017[225] bylo:
- virus podobný A/Michigan/45/2015 (H1N1)pdm09[note 1][226]
- virus podobný A/Hong Kong/4801/2014 (H3N2)
- virus podobný B/Brisbane/60/2008 (rod Viktorie)
Kromě těchto složek budou quadrivalentní vakcíny obsahovat také virus podobný B/Phuket/3073/2013 (linie Yamagata).
V Kalifornii byly některé nouzové systémy pod prudkým nárůstem případů chřipky H3N2. V některých oblastech navíc došlo k místnímu nedostatku oseltamiviru.[227] Závažnost chřipkové sezóny se zdála být srovnatelná s vypuknutím prasečí chřipky v letech 2009–2010. Průběžná zpráva CDC z února 2018 odhaduje účinnost vakcíny na 25 % proti H3N2, 67 % proti H1N1 a 42 % proti chřipce B.[228][229]
2018 chřipková sezóna na jižní polokouli[editovat | editovat zdroj]
Složení virových vakcín pro použití v chřipkové sezóně 2018 na jižní polokouli doporučené Světovou zdravotnickou organizací dne 28. září 2017 bylo:[230]
- virus podobný A/Michigan/45/2015 (H1N1)pdm09[note 1][226]
- virus podobný A/Singapur/INFIMH-16-0019/2016 (H3N2)
- virus podobný B/Phuket/3073/2013
WHO doporučila, aby quadrivalentní vakcíny obsahující dva viry chřipky B obsahovaly výše uvedené tři viry a virus podobný B/Brisbane/60/2008.[231][230]
2018–2019 chřipková sezóna na severní polokouli[editovat | editovat zdroj]
Složení virových vakcín pro použití v sezóně chřipky na severní polokouli 2018–2019 doporučené Světovou zdravotnickou organizací dne 22. února 2018 bylo:[232][233]
- virus podobný A/Michigan/45/2015 (H1N1)pdm09
- virus podobný A/Singapur/INFIMH-16-0019/2016 (H3N2)
- virus podobný B/Colorado/06/2017 (rod B/Victoria/2/87)
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata/16/88)
WHO doporučila, aby trivalentní vakcíny používaly jako virus chřipky B virus podobný B/Colorado/06/2017 z linie B/Victoria/2/87.[234][232] Průběžná zpráva CDC z února 2019 odhadla účinnost vakcíny proti chřipkovým kmenům z let 2018–2019 na přibližně 47 %.[51][53]
Složení virových vakcín pro použití ve Spojených státech pro chřipkovou sezónu na severní polokouli 2018–2019 doporučené Food and Drug Administration dne 1. března 2018 bylo:[235]
- virus podobný A/Michigan/45/2015 (H1N1)pdm09
- virus podobný A/Singapur/INFIMH-16-0019/2016 (H3N2)
- virus podobný B/Colorado/06/2017 (linie B/Victoria)
Výbor také doporučil, aby quadrivalentní vakcíny proti chřipce obsahovaly výše uvedené tři kmeny a následující další kmen B:[235]
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata)
2019 chřipková sezóna na jižní polokouli[editovat | editovat zdroj]
Složení virových vakcín pro použití v sezóně chřipky na jižní polokouli 2019 doporučené Světovou zdravotnickou organizací v září 2018 bylo:[236]
- virus podobný A/Michigan/45/2015 (H1N1)pdm09
- virus podobný A/Switzerland/8060/2017 (H3N2)
- virus podobný B/Colorado/06/2017 (rod B/Victoria/2/87)
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata/16/88)
WHO doporučila, aby trivalentní vakcíny používaly jako virus chřipky B virus podobný B/Colorado/06/2017 z linie B/Victoria/2/87.[236]
2019–2020 chřipková sezóna na severní polokouli[editovat | editovat zdroj]
Složení virových vakcín pro použití v sezóně chřipky na severní polokouli 2019–2020 doporučené Světovou zdravotnickou organizací dne 21. března 2019 bylo:
- virus podobný A/Brisbane/02/2018 (H1N1)pdm09[note 1][237]
- virus podobný A/Kansas/14/2017 (H3N2)
- virus podobný B/Colorado/06/2017 (rod B/Victoria/2/87)
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata/16/88)
WHO doporučila, aby trivalentní vakcíny používaly jako virus chřipky B virus podobný B/Colorado/06/2017 z linie B/Victoria/2/87.[238]
- Spojené státy
Složení virových vakcín pro použití ve Spojených státech pro chřipkovou sezónu na severní polokouli 2019–2020 doporučené Food and Drug Administration (FDA) dne 22. března 2019 bylo:[239][240][241]
- virus podobný A/Brisbane/02/2018 (H1N1)pdm09
- virus podobný A/Kansas/14/2017 (H3N2)
- virus podobný B/Colorado/06/2017 (linie B/Victoria)
Výbor také doporučil, aby quadrivalentní vakcíny proti chřipce obsahovaly výše uvedené tři kmeny a následující další kmen B:[239]
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata)
- Evropská unie
Složení virových vakcín pro použití v Evropské unii pro chřipkovou sezónu na severní polokouli 2019–2020 doporučené Evropskou lékovou agenturou 15. května 2019 je:[242]
Trivalentní vakcíny by měly obsahovat:
- virus podobný A/Brisbane/02/2018 (H1N1)pdm09
- virus podobný A/Kansas/14/2017 (H3N2)
- virus podobný B/Colorado/06/2017 (linie B/Victoria/2/87)
Pro výrobce vakcín, kteří zvažují použití očkovacího viru virové linie B/Yamagata/16/88 ve quadrivalentních vakcínách obsahujících dva viry chřipky B, byl kromě výše uvedených kmenů považován za vhodný také virus podobný B/Phuket/3073/2013.[242]
2020 chřipková sezóna na jižní polokouli[editovat | editovat zdroj]
Složení virových vakcín pro použití v chřipkové sezóně 2020 na jižní polokouli doporučené Světovou zdravotnickou organizací v září 2019 bylo:[243]
- virus podobný A/Brisbane/02/2018 (H1N1)pdm09
- virus podobný A/South Australia/34/2019 (H3N2)
- virus podobný B/Washington/02/2019 (Linie B/Victoria)
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata)
WHO doporučila, aby trivalentní vakcíny používaly jako virus chřipky B virus podobný B/Washington/02/2019 (B/Victoria linie) virus.[243]
2020–2021 chřipková sezóna na severní polokouli[editovat | editovat zdroj]
Složení virových vakcín pro použití v chřipkové sezóně na severní polokouli 2020–2021 doporučené Světovou zdravotnickou organizací 28. února 2020 je:[244]
na bázi vajec:
- virus podobný A/Guangdong-Maonan/SWL1536/2019 (H1N1)pdm09
- virus podobný A/Hong Kong/2671/2019 (H3N2)
- virus podobný B/Washington/02/2019 (Linie B/Victoria)
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata)
pro buňky nebo rekombinantní:
- virus podobný A/Hawaii/70/2019 (H1N1)pdm09
- virus podobný A/Hong Kong/45/2019 (H3N2)
- virus podobný B/Washington/02/2019 (Linie B/Victoria)
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata)
WHO doporučuje, aby trivalentní vakcíny používaly jako virus chřipky B virus podobný B/Washington/02/2019 (B/Victoria lineage).[244]
- Spojené státy
Poradní výbor pro vakcíny a příbuzné biologické produkty (VRBPAC) Úřadu pro kontrolu potravin a léčiv (FDA) doporučil, aby quadrivalentní formulace vakcín proti chřipce na bázi vajec pro chřipkovou sezónu v USA 2020–2021 obsahovala následující:[245]
- virus podobný A/Guangdong-Maonan/SWL1536/2019 (H1N1)pdm09
- virus podobný A/HongKong/2671/2019 (H3N2)
- virus podobný B/Washington/02/2019 (linie B/Victoria)
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata)
Výbor doporučil, aby quadrivalentní formulace vakcín proti chřipce na bázi buněk nebo rekombinantních vakcín pro chřipkovou sezónu v USA 2020–2021 obsahovala následující:[245]
- virus podobný A/Hawaii/70/2019 (H1N1)pdm09
- virus podobný A/HongKong/45/2019 (H3N2)
- virus podobný B/Washington/02/2019 (linie B/Victoria)
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata)
Pro trivalentní vakcíny proti chřipce pro použití v USA pro chřipkovou sezónu 2020–2021 výbor v závislosti na metodě výroby vakcíny doporučil viry A(H1N1)pdm09, A(H3N2) a B/Victoria (uvedené výše pro quadrivalentní vakcínu).[245]
- Evropská unie
Složení virových vakcín pro použití v Evropské unii pro chřipkovou sezónu na severní polokouli 2020–2021 doporučené Evropskou lékovou agenturou dne 1. dubna 2020 bylo:[246]
Trivalentní vakcíny na bázi vajec nebo živé oslabené vakcíny by měly obsahovat:[246]
- virus podobný A/Guangdong-Maonan/SWL1536/2019 (H1N1)pdm09
- virus podobný A/Hong Kong/2671/2019 (H3N2)
- virus podobný B/Washington/02/2019 (Linie B/Victoria)
Trivalentní vakcíny na bázi buněk by měly obsahovat:[246]
- virus podobný A/Hawaii/70/2019 (H1N1)pdm09
- virus podobný A/Hong Kong/45/2019 (H3N2)
- virus podobný B/Washington/02/2019 (Linie B/Victoria)
Kromě kmenů uvedených výše se pro quadrivalentní vakcíny doporučuje virus podobný AB/Phuket/3073/2013.[246]
2021 chřipková sezóna na jižní polokouli[editovat | editovat zdroj]
Složení vakcín pro použití v chřipkové sezóně 2021 na jižní polokouli doporučené Světovou zdravotnickou organizací v září 2020:[247]
Pro vaječné (trivalentní):
- virus podobný A/Victoria/2570/2019 (H1N1)pdm09
- virus podobný A/Hong Kong/2671/2019 (H3N2)
- virus podobný B/Washington/02/2019 (Linie B/Victoria)
Pro buněčné nebo rekombinantní (trivalentní):
- virus podobný A/Wisconsin/588/2019 (H1N1)pdm09
- virus podobný A/Hong Kong/45/2019 (H3N2)
- virus podobný B/Washington/02/2019 (Linie B/Victoria)
Quadrivalentní verze by měla kromě výše uvedeného obsahovat:
- virus podobný B/Phuket/3073/2013 (linie B/Yamagata)
V Austrálii je standardní vakcína v rámci Národního imunizačního programu pro rok 2021 quadrivalentní.[248]
2021–2022 chřipková sezóna na severní polokouli[editovat | editovat zdroj]
Složení virových vakcín pro použití v chřipkové sezóně 2021–2022 na severní polokouli je:
- Evropská unie
Složení virových vakcín pro použití v Evropské unii pro chřipkovou sezónu na severní polokouli 2021–2022 doporučené Evropskou lékovou agenturou 30. března 2021 je:[249][250]
Trivalentní vakcíny na bázi vajec nebo živé oslabené vakcíny by měly obsahovat:[249]
- virus podobný A/Victoria/2570/2019 (H1N1)pdm09
- virus podobný A/Cambodia/e0826360/2020 (H3N2)
- virus podobný B/Washington/02/2019 (Linie B/Victoria)
Trivalentní vakcíny na bázi buněk by měly obsahovat:[249]
- virus podobný A/Wisconsin/588/2019 (H1N1)pdm09
- virus podobný A/Cambodia/e0826360/2020 (H3N2)
- virus podobný B/Washington/02/2019 (Linie B/Victoria)
Kromě kmenů uvedených výše se pro quadrivalentní vakcíny doporučuje virus podobný AB/Phuket/3073/2013.[249]
Odkazy[editovat | editovat zdroj]
Poznámky[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Influenza vaccine na anglické Wikipedii.
- ↑ a b c d e f g h WORLD HEALTH ORGANIZATION. Vaccines against influenza WHO position paper — November 2012 = Note de synthèse de l’OMS concernant les vaccins antigrippaux — novembre 2012. Weekly Epidemiological Record = Relevé épidémiologique hebdomadaire. 2012, roč. 87, čís. 47, s. 461–476. Dostupné online [cit. 2021-11-16]. (anglicky)
- ↑ Manzoli L, Ioannidis JP, Flacco ME, De Vito C, Villari P. Effectiveness and harms of seasonal and pandemic influenza vaccines in children, adults and elderly: a critical review and re-analysis of 15 meta-analyses. Human Vaccines & Immunotherapeutics. July 2012, s. 851–62. DOI 10.4161/hv.19917. PMID 22777099.
- ↑ 2015-2016 Estimated Influenza Illnesses, Medical Visits, Hospitalizations, and Deaths Averted by Vaccination in the United States | CDC. www.cdc.gov [online]. 2019-12-20 [cit. 2021-11-16]. Dostupné online. (anglicky)
- ↑ CDC. Benefits of Flu Vaccination During 2018-2019 Flu Season. Centers for Disease Control and Prevention [online]. 2020-01-16 [cit. 2021-11-16]. Dostupné online. (anglicky)
- ↑ a b c d e f Demicheli V, Jefferson T, Ferroni E, Rivetti A, Di Pietrantonj C. Vaccines for preventing influenza in healthy adults. Cochrane Database of Systematic Reviews. February 2018, s. CD001269. DOI 10.1002/14651858.CD001269.pub6. PMID 29388196.
- ↑ a b c Osterholm MT, Kelley NS, Sommer A, Belongia EA. Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis. The Lancet. Infectious Diseases. January 2012, s. 36–44. DOI 10.1016/S1473-3099(11)70295-X. PMID 22032844.
- ↑ a b Demicheli V, Jefferson T, Di Pietrantonj C, Ferroni E, Thorning S, Thomas RE, Rivetti A. Vaccines for preventing influenza in the elderly. Cochrane Database of Systematic Reviews. February 2018, s. CD004876. DOI 10.1002/14651858.CD004876.pub4. PMID 29388197.
- ↑ https://medicalxpress.com/news/2022-02-seasonal-influenza-vaccines-kids-future.html - Repeated seasonal influenza vaccines also provide kids better protection against future flu pandemics, study finds
- ↑ Vaccines for pandemic influenza. Dordrecht: Springer 1 online resource (xviii, 512 pages) s. Dostupné online. ISBN 978-3-540-92165-3, ISBN 3-540-92165-6. OCLC 489216221
- ↑ Vaccine analysis : strategies, principles, and control. Heidelberg: [s.n.] 1 online resource (xii, 665 pages) s. Dostupné online. ISBN 978-3-662-45024-6, ISBN 3-662-45024-0. OCLC 897377107
- ↑ [s.l.]: [s.n.] WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ a b c d CDC. Who Should and Who Should NOT Get Vaccinated. Centers for Disease Control and Prevention [online]. 2021-08-24 [cit. 2021-11-16]. Dostupné online. (anglicky)
- ↑ WORLD HEALTH ORGANIZATION. The immunological basis for immunization series: module 23: influenza vaccines. [s.l.]: World Health Organization 63 s. Dostupné online. ISBN 978-92-4-151305-0. (anglicky)
- ↑ a b c d e f g h i j k l m n o p q r s Grohskopf LA, Alyanak E, Ferdinands JM, Broder KR, Blanton LH, Talbot HK, Fry AM. Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices, United States, 2021-22 Influenza Season. MMWR Recomm Rep. August 2021, s. 1–28. Dostupné online. DOI 10.15585/mmwr.rr7005a1. PMID 34448800.
- ↑ https://www.ecdc.europa.eu/sites/default/files/media/en/publications/Publications/Implementation-seasonal-influenza-vaccination-Council-Recommendation-Jan-2014.pdf
- ↑ a b c d e CDC. Flu Vaccine and People with Egg Allergies. Centers for Disease Control and Prevention [online]. 2020-09-22 [cit. 2021-11-16]. Dostupné online. (anglicky)
- ↑ a b c d There's the option of a different flu jab this year — but it'll cost you $40. ABC News. 2021-03-26. Dostupné online [cit. 2021-11-16]. (anglicky)
- ↑ Novartis: Novartis receives FDA approval for Flucelvax, the first cell-culture vaccine in US to help protect against seasonal influenza, tisková zpráva, [cit. {{{accessdate}}}], Dostupné on-line.
- ↑ a b https://www.ema.europa.eu/en/medicines/human/EPAR/supemtek
- ↑ https://www.cdc.gov/flu/prevent/qa_intradermal-vaccine.htm
- ↑ TABLE 1. Influenza vaccines — United States, 2020–21 influenza season* | CDC. www.cdc.gov [online]. 2021-08-25 [cit. 2021-11-16]. Dostupné online. (anglicky)
- ↑ Dostupné online.
- ↑ [s.l.]: [s.n.] ISBN 978-0-309-09504-4. DOI 10.17226/11150.
- ↑ Plotkin, S.L. and Plotkin, S.A. "A short history of vaccination".
- ↑ Artenstein, A.W. "Influenza" In: Vaccines: A Biography Andrew W. Artenstein, ed. pp. 191–205.
- ↑ Hampson AW. Vaccines for pandemic influenza. The history of our current vaccines, their limitations and the requirements to deal with a pandemic threat. Annals of the Academy of Medicine, Singapore. June 2008, s. 510–17. PMID 18618064.
- ↑ Milián E, Kamen AA. Current and emerging cell culture manufacturing technologies for influenza vaccines. Biomed Res Int. 2015, s. 504831. DOI 10.1155/2015/504831. PMID 25815321.
- ↑ https://web.archive.org/web/20130102094936/https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm328982.htm
- ↑ Cell-Based Flu Vaccines | CDC. www.cdc.gov [online]. 2021-05-06 [cit. 2021-11-17]. Dostupné online. (anglicky)
- ↑ https://web.archive.org/web/20130518014553/https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm335891.htm
- ↑ Landry N, Ward BJ, Trépanier S, Montomoli E, Dargis M, Lapini G, Vézina LP. Preclinical and clinical development of plant-made virus-like particle vaccine against avian H5N1 influenza. PLOS ONE. December 2010, s. e15559. DOI 10.1371/journal.pone.0015559. PMID 21203523. Bibcode 2010PLoSO...515559L.
- ↑ Osterholm MT. Preparing for the next pandemic. The New England Journal of Medicine. May 2005, s. 1839–42. DOI 10.1056/NEJMp058068. PMID 15872196.
- ↑ https://web.archive.org/web/19991009112042/http://www.haverford.edu/biology/edwards/disease/viral_essays/warnervirus.htm
- ↑ McCullers JA, Van De Velde LA, Allison KJ, Branum KC, Webby RJ, Flynn PM. Recipients of vaccine against the 1976 "swine flu" have enhanced neutralization responses to the 2009 novel H1N1 influenza virus. Clinical Infectious Diseases. June 2010, s. 1487–92. DOI 10.1086/652441. PMID 20415539.
- ↑ First Quadrivalent Vaccine Against Seasonal Flu Wins FDA Approval. www.medicalnewstoday.com [online]. 2012-03-02 [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ FDA approves first quadrivalent vaccine to prevent seasonal influenza. web.archive.org [online]. 2012-12-21 [cit. 2021-11-18]. Dostupné v archivu pořízeném z originálu dne 2012-12-21.
- ↑ Dostupné online.
- ↑ [s.l.]: [s.n.] Dostupné online. ISBN 978-1-100-24682-6. Cat.: HP40-117/2014E-PDF Pub.: 140118.
- ↑ CDC. What You Should Know for the 2018-2019 Influenza Season. Centers for Disease Control and Prevention [online]. 2019-04-08 [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ a b c d e f g CDC. Upcoming 2019-2020 Influenza Season. Centers for Disease Control and Prevention [online]. 2020-01-17 [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ RESEARCH, Center for Biologics Evaluation and. Fluzone Quadrivalent, Fluzone High-Dose Quadrivalent, Fluzone, Intradermal Quadrivalent, Fluzone Quadrivalent Southern Hemisphere. FDA. 2021-09-27. Dostupné online [cit. 2021-11-18]. (anglicky)
- ↑ FDA approves Fluzone® High-Dose Quadrivalent (Influenza Vaccine) for adults 65 years of age and older - Nov 4, 2019. www.news.sanofi.us [online]. [cit. 2021-11-18]. Dostupné online.
- ↑ a b c RESEARCH, Center for Biologics Evaluation and. FLUAD QUADRIVALENT. FDA. 2021-07-06. Dostupné online [cit. 2021-11-18]. (anglicky)
- ↑ Seqirus Receives FDA Approval for FLUAD® Quadrivalent for Adults 65 Years and Older. www.seqirus.us [online]. [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ Seqirus Begins Shipping 2020/21 Influenza Vaccines to U.S. Market. www.seqirus.us [online]. [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ a b c d e f CDC. Key Facts About Seasonal Flu Vaccine. Centers for Disease Control and Prevention [online]. 2021-10-19 [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ a b Flu vaccine. nhs.uk [online]. 2019-07-31 [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ Osterholm MT, Kelley NS, Sommer A, Belongia EA. Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis. The Lancet. Infectious Diseases. January 2012, s. 36–44. DOI 10.1016/s1473-3099(11)70295-x. PMID 22032844.
- ↑ MACINTYRE, CR; MAHIMBO, A; MOA, AM; BARNES, M. Influenza vaccine as a coronary intervention for prevention of myocardial infarction.. Heart (British Cardiac Society). December 15, 2016, s. 1953–56. DOI 10.1136/heartjnl-2016-309983. PMID 27686519.
- ↑ Past Seasons Vaccine Effectiveness Estimates | CDC. www.cdc.gov [online]. 2021-08-26 [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ a b Doyle JD, Chung JR, Kim SS, Gaglani M, Raiyani C, Zimmerman RK, Nowalk MP, Jackson ML, Jackson LA, Monto AS, Martin ET, Belongia EA, McLean HQ, Foust A, Sessions W, Berman L, Garten RJ, Barnes JR, Wentworth DE, Fry AM, Patel MM, Flannery B. Interim Estimates of 2018-19 Seasonal Influenza Vaccine Effectiveness – United States, February 2019. MMWR. Morbidity and Mortality Weekly Report. February 2019, s. 135–39. Dostupné online. DOI 10.15585/mmwr.mm6806a2. PMID 30763298.
- ↑ Seasonal Influenza Vaccine Effectiveness, 2018-2019. www.cdc.gov [online]. 2020-12-22 [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ a b Dawood FS, Chung JR, Kim SS, Zimmerman RK, Nowalk MP, Jackson ML, Jackson LA, Monto AS, Martin ET, Belongia EA, McLean HQ, Gaglani M, Dunnigan K, Foust A, Sessions W, DaSilva J, Le S, Stark T, Kondor RJ, Barnes JR, Wentworth DE, Brammer L, Fry AM, Patel MM, Flannery B. Interim Estimates of 2019-20 Seasonal Influenza Vaccine Effectiveness - United States, February 2020. MMWR Morb Mortal Wkly Rep. February 2020, s. 177–82. Dostupné online. DOI 10.15585/mmwr.mm6907a1. PMID 32078591.
- ↑ Fedson DS. Measuring protection: efficacy versus effectiveness. Developments in Biological Standardization. 1998, s. 195–201. PMID 9855432.
- ↑ Stephenson I, Zambon MC, Rudin A, Colegate A, Podda A, Bugarini R, Del Giudice G, Minutello A, Bonnington S, Holmgren J, Mills KH, Nicholson KG. Phase I evaluation of intranasal trivalent inactivated influenza vaccine with nontoxigenic Escherichia coli enterotoxin and novel biovector as mucosal adjuvants, using adult volunteers. Journal of Virology. May 2006, s. 4962–70. DOI 10.1128/JVI.80.10.4962-4970.2006. PMID 16641287.
- ↑ Jefferson T. Influenza vaccination: policy versus evidence. BMJ. October 2006, s. 912–15. DOI 10.1136/bmj.38995.531701.80. PMID 17068038.
- ↑ Summary of the 2007-2008 Influenza Season | CDC. www.cdc.gov [online]. 2019-05-14 [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ CARRAT, F.; FLAHAULT, A. Influenza vaccine: The challenge of antigenic drift. Vaccine. September 28, 2007, s. 6852–62. ISSN 0264-410X. DOI 10.1016/j.vaccine.2007.07.027. PMID 17719149.
- ↑ a b Vaccine Effectiveness: How Well Do Flu Vaccines Work? | CDC. www.cdc.gov [online]. 2021-10-25 [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ Ramsay LC, Buchan SA, Stirling RG, Cowling BJ, Feng S, Kwong JC, Warshawsky BF. The impact of repeated vaccination on influenza vaccine effectiveness: a systematic review and meta-analysis. BMC Med. January 2019, s. 9. DOI 10.1186/s12916-018-1239-8. PMID 30626399.
- ↑ Belongia EA, Skowronski DM, McLean HQ, Chambers C, Sundaram ME, De Serres G. Repeated annual influenza vaccination and vaccine effectiveness: review of evidence. Expert Rev Vaccines. July 2017, s. 723–36. DOI 10.1080/14760584.2017.1334554. PMID 28562111.
- ↑ Flu jab vital this winter along with Covid vaccine. BBC News. 2021-10-08. Dostupné online [cit. 2021-11-18]. (anglicky)
- ↑ LENZER, Shannon Brownlee, Jeanne. Does the Vaccine Matter?. The Atlantic [online]. 2009-11-01 [cit. 2021-11-18]. Dostupné online. (anglicky)
- ↑ well.blogs.nytimes.com. Dostupné online.
- ↑ a b Influenza (Seasonal). www.who.int [online]. [cit. 2021-11-19]. Dostupné online. (anglicky)
- ↑ Study of Flu-Related Deaths in Children Shows Healthy Children at Risk | CDC. www.cdc.gov [online]. 2019-03-11 [cit. 2021-11-19]. Dostupné online. (anglicky)
- ↑ a b Jefferson T, Rivetti A, Di Pietrantonj C, Demicheli V. Vaccines for preventing influenza in healthy children. Cochrane Database of Systematic Reviews. February 2018, s. CD004879. DOI 10.1002/14651858.CD004879.pub5. PMID 29388195.
- ↑ U.S. CDC director urges flu vaccinations as pediatric deaths mount. Reuters. 2018-01-22. Dostupné online [cit. 2021-11-19]. (anglicky)
- ↑ RESEARCH, Center for Biologics Evaluation and. Fluzone Quadrivalent, Fluzone High-Dose Quadrivalent, Fluzone, Intradermal Quadrivalent, Fluzone Quadrivalent Southern Hemisphere. FDA. 2021-09-27. Dostupné online [cit. 2021-11-19]. (anglicky)
- ↑ RESEARCH, Center for Biologics Evaluation and. Afluria Quadrivalent, Afluria Quadrivalent Southern Hemisphere. FDA. 2021-07-06. Dostupné online [cit. 2021-11-19]. (anglicky)
- ↑ CANADA, Public Health Agency of. Supplemental Statement - Afluria Tetra - An Advisory Committee Statement (ACS). www.canada.ca [online]. 2019-01-24 [cit. 2022-01-04]. Dostupné online.
- ↑ GOVERNMENT OF CANADA, Public Services and Procurement Canada. Information archivée dans le Web. publications.gc.ca [online]. [cit. 2021-11-21]. Dostupné v archivu pořízeném z originálu dne 2022-01-19.
- ↑ https://www.canada.ca/content/dam/phac-aspc/migration/phac-aspc/naci-ccni/assets/pdf/pediatric-pediatrique-fluad-eng.pdf
- ↑ PELEG, Noam; ZEVIT, Noam; SHAMIR, Raanan; CHODICK, Gabriel; LEVY, Itzhak. Seasonal influenza vaccination rates and reasons for non-vaccination in children with gastrointestinal disorders. Vaccine. January 2015, s. 182–86. DOI 10.1016/j.vaccine.2014.10.086. PMID 25444802.
- ↑ a b Burls A, Jordan R, Barton P, Olowokure B, Wake B, Albon E, Hawker J. Vaccinating healthcare workers against influenza to protect the vulnerable – is it a good use of healthcare resources? A systematic review of the evidence and an economic evaluation. Vaccine. May 2006, s. 4212–21. DOI 10.1016/j.vaccine.2005.12.043. PMID 16546308.
- ↑ Ahmed F, Lindley MC, Allred N, Weinbaum CM, Grohskopf L. Effect of influenza vaccination of healthcare personnel on morbidity and mortality among patients: systematic review and grading of evidence. Clinical Infectious Diseases. January 2014, s. 50–57. DOI 10.1093/cid/cit580. PMID 24046301.
- ↑ Griffin MR. Influenza vaccination of healthcare workers: making the grade for action. Clinical Infectious Diseases. January 2014, s. 58–60. DOI 10.1093/cid/cit590. PMID 24046312.
- ↑ Simonsen L, Viboud C, Taylor RJ, Miller MA, Jackson L. Influenza vaccination and mortality benefits: new insights, new opportunities. Vaccine. October 2009, s. 6300–04. DOI 10.1016/j.vaccine.2009.07.008. PMID 19840664.
- ↑ Darvishian M, Bijlsma MJ, Hak E, van den Heuvel ER. Effectiveness of seasonal influenza vaccine in community-dwelling elderly people: a meta-analysis of test-negative design case-control studies. The Lancet. Infectious Diseases. December 2014, s. 1228–39. DOI 10.1016/S1473-3099(14)70960-0. PMID 25455990.
- ↑ Nichol KL, Nordin JD, Nelson DB, Mullooly JP, Hak E. Effectiveness of influenza vaccine in the community-dwelling elderly. The New England Journal of Medicine. October 2007, s. 1373–81. Dostupné online. DOI 10.1056/NEJMoa070844. PMID 17914038. S2CID 14850833.
- ↑ Simonsen L, Taylor RJ, Viboud C, Miller MA, Jackson LA. Mortality benefits of influenza vaccination in elderly people: an ongoing controversy. The Lancet. Infectious Diseases. October 2007, s. 658–66. DOI 10.1016/S1473-3099(07)70236-0. PMID 17897608.
- ↑ Thompson WW, Shay DK, Weintraub E, Brammer L, Cox N, Anderson LJ, Fukuda K. Mortality associated with influenza and respiratory syncytial virus in the United States. JAMA. January 2003, s. 179–86. DOI 10.1001/jama.289.2.179. PMID 12517228. S2CID 5018362.
- ↑ High Dose Flu Vaccine for the Elderly | Science-Based Medicine. sciencebasedmedicine.org [online]. 2010-10-19 [cit. 2021-11-19]. Dostupné online. (anglicky)
- ↑ Fluzone High-Dose Seasonal Influenza Vaccine | CDC. www.cdc.gov [online]. 2021-08-27 [cit. 2021-11-19]. Dostupné online. (anglicky)
- ↑ DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A, Pollak R, Christoff J, Earl J, Landolfi V, Martin E, Gurunathan S, Nathan R, Greenberg DP, Tornieporth NG, Decker MD, Talbot HK. Efficacy of high-dose versus standard-dose influenza vaccine in older adults. The New England Journal of Medicine. August 2014, s. 635–45. Dostupné online. DOI 10.1056/NEJMoa1315727. PMID 25119609. S2CID 205096393.
- ↑ Wells C, Grobelna A. High Dose Influenza Vaccine for Adults: A Review of Clinical Effectiveness, Cost-Effectiveness, and Guidelines. Rapid Response Report. Ottawa: Canadian Agency for Drugs and Technologies in Health (CADTH), January 8, 2019. Dostupné online. ISSN 1922-8147. PMID 31141324.
- ↑ Mascagni P, Vicenzi E, Kajaste-Rudnitski A, Pellicciotta G, Monti A, Cervi C, Vitalucci R, Toffoletto F. Assessment of efficacy and safety of pandemic A/H1N1/2009 influenza vaccine in a group of health care workers. La Medicina del Lavoro. 2012, s. 220–29. PMID 22838300.
- ↑ FDA approves first seasonal influenza vaccine containing an adjuvant. web.archive.org [online]. 2017-07-22 [cit. 2021-11-20]. Dostupné v archivu pořízeném z originálu dne 2017-07-22.
- ↑ a b RESEARCH, Center for Biologics Evaluation and. FLUAD. FDA. 2021-07-06. Dostupné online [cit. 2021-11-19]. (anglicky)
- ↑ Fluad [online]. November 8, 2019 [cit. 2019-12-02]. Dostupné v archivu pořízeném z originálu dne December 2, 2019. STN 125510.
- ↑ Influenza vaccine with squalene adjuvant: new preparation. No better than available products. Prescrire International. December 2004, s. 206–08. PMID 15599987.
- ↑ Camilloni B, Basileo M, Valente S, Nunzi E, Iorio AM. Immunogenicity of intramuscular MF59-adjuvanted and intradermal administered influenza enhanced vaccines in subjects aged over 60: A literature review. Human Vaccines & Immunotherapeutics. 2015, s. 553–63. DOI 10.1080/21645515.2015.1011562. PMID 25714138.
- ↑ Van Damme P, Arnou R, Kafeja F, Fiquet A, Richard P, Thomas S, Meghlaoui G, Samson SI, Ledesma E. Evaluation of non-inferiority of intradermal versus adjuvanted seasonal influenza vaccine using two serological techniques: a randomised comparative study. BMC Infectious Diseases. May 2010, s. 134. DOI 10.1186/1471-2334-10-134. PMID 20504306.
- ↑ Haverkate M, D'Ancona F, Giambi C, Johansen K, Lopalco PL, Cozza V, Appelgren E, ((VENICE project gatekeepers contact points)). Mandatory and recommended vaccination in the EU, Iceland and Norway: results of the VENICE 2010 survey on the ways of implementing national vaccination programmes. Euro Surveillance. May 2012. DOI 10.2807/ese.17.22.20183-en. PMID 22687916.
- ↑ Field RI. Mandatory vaccination of health care workers: whose rights should come first?. P & T. November 2009, s. 615–18. PMID 20140133.
- ↑ Kassianos G. Willingness of European healthcare workers to undergo vaccination against seasonal influenza: current situation and suggestions for improvement. Drugs in Context. 2015, s. 212268. DOI 10.7573/dic.212268. PMID 25657810.
- ↑ Thomas RE, Jefferson T, Lasserson TJ. Influenza vaccination for healthcare workers who care for people aged 60 or older living in long-term care institutions. The Cochrane Database of Systematic Reviews. June 2016, s. CD005187. DOI 10.1002/14651858.CD005187.pub5. PMID 27251461.
- ↑ Fluad Quad Australian prescription medicine decision summary [online]. December 13, 2019 [cit. 2020-08-24]. Dostupné online.
- ↑ Fluad Tetra EPAR [online]. March 24, 2020 [cit. 2020-05-29]. Dostupné online.
- ↑ Fell DB, Sprague AE, Liu N, Yasseen AS, Wen SW, Smith G, Walker MC. H1N1 influenza vaccination during pregnancy and fetal and neonatal outcomes. American Journal of Public Health. June 2012, s. e33–40. DOI 10.2105/AJPH.2011.300606. PMID 22515877.
- ↑ Madhi SA, Cutland CL, Kuwanda L, Weinberg A, Hugo A, Jones S, Adrian PV, van Niekerk N, Treurnicht F, Ortiz JR, Venter M, Violari A, Neuzil KM, Simões EA, Klugman KP, Nunes MC. Influenza vaccination of pregnant women and protection of their infants. The New England Journal of Medicine. September 2014, s. 918–31. DOI 10.1056/NEJMoa1401480. PMID 25184864.
- ↑ Flu shot [online]. 2020 [cit. 2020-09-24]. Dostupné online.
- ↑ Misconceptions about flu vaccines [online]. 2020 [cit. 2020-09-24]. Dostupné online.
- ↑ Haber P, Sejvar J, Mikaeloff Y, DeStefano F. Vaccines and Guillain-Barré syndrome. Drug Safety. 2009, s. 309–23. DOI 10.2165/00002018-200932040-00005. PMID 19388722. S2CID 33670594.
- ↑ Reorganized text. JAMA Otolaryngology–Head & Neck Surgery. May 2015, s. 428. DOI 10.1001/jama.248.6.698. PMID 25996397.
- ↑ Stowe J, Andrews N, Wise L, Miller E. Investigation of the temporal association of Guillain-Barre syndrome with influenza vaccine and influenza-like illness using the United Kingdom General Practice Research Database. American Journal of Epidemiology. February 2009, s. 382–88. DOI 10.1093/aje/kwn310. PMID 19033158.
- ↑ a b Sivadon-Tardy V, Orlikowski D, Porcher R, Sharshar T, Durand MC, Enouf V, Rozenberg F, Caudie C, Annane D, van der Werf S, Lebon P, Raphaël JC, Gaillard JL, Gault E. Guillain-Barré syndrome and influenza virus infection. Clinical Infectious Diseases. January 2009, s. 48–56. DOI 10.1086/594124. PMID 19025491.
- ↑ Vellozzi C, Burwen DR, Dobardzic A, Ball R, Walton K, Haber P. Safety of trivalent inactivated influenza vaccines in adults: background for pandemic influenza vaccine safety monitoring. Vaccine. March 2009, s. 2114–20. Dostupné online. DOI 10.1016/j.vaccine.2009.01.125. PMID 19356614.
- ↑ REINBERG, Steven. Last Year's H1N1 Flu Vaccine Was Safe, Study Finds. U.S. News & World Report. February 2, 2011. Dostupné v archivu pořízeném z originálu dne April 25, 2013.
- ↑ ((National Advisory Committee on Immunization (NACI))). Statement on Seasonal Influenza Vaccine for 2012–2013. Canada Communicable Disease Report. Ottawa: August 2012. Dostupné v archivu pořízeném z originálu dne January 17, 2013.
- ↑ Turner PJ, Southern J, Andrews NJ, Miller E, Erlewyn-Lajeunesse M. Safety of live attenuated influenza vaccine in young people with egg allergy: multicentre prospective cohort study. BMJ. December 2015, s. h6291. DOI 10.1136/bmj.h6291. PMID 26645895.
- ↑ Greenhawt M. Live attenuated influenza vaccine for children with egg allergy. BMJ. December 2015, s. h6656. DOI 10.1136/bmj.h6656. PMID 26657778. S2CID 37037904.
- ↑ Technical Report: Narcolepsy in association with pandemic influenza vaccination. Stockholm, Sweden: European Centre for Disease Prevention and Control (ECDC), 2012. Dostupné v archivu pořízeném z originálu dne December 31, 2013. ISBN 978-92-9193-388-4.
- ↑ YONG, Ed. Narcolepsy confirmed as autoimmune disease. Nature. 2013. DOI 10.1038/nature.2013.14413. S2CID 74850662.
- ↑ Thimerosal in Flu Vaccine [online]. October 16, 2015 [cit. 2019-12-02]. Dostupné v archivu pořízeném z originálu dne December 2, 2019.
- ↑ Thimerosal in Vaccines Thimerosal – Concerns – Vaccine Safety [online]. October 27, 2015 [cit. 2019-12-02]. Dostupné v archivu pořízeném z originálu dne November 2, 2019.
- ↑ Offit PA. Thimerosal and vaccines – a cautionary tale. The New England Journal of Medicine. September 2007, s. 1278–79. Dostupné online. DOI 10.1056/NEJMp078187. PMID 17898096. S2CID 36318722.
- ↑ Global Advisory Committee on Vaccine Safety. Thiomersal and vaccines [online]. World Health Organization (WHO), July 14, 2006 [cit. 2007-11-20]. Dostupné v archivu pořízeném z originálu dne November 6, 2009.
- ↑ PLOTKIN & MORTIMER. Vaccines. Philadelphia: W.B. Saunders Company, 1988. Dostupné online. ISBN 978-0-7216-1946-0. S. 424.
- ↑ Product Monograph: Flumist. [s.l.]: Astrazeneca Canada Inc., June 20, 2014. Dostupné online.
- ↑ To KW, Lai A, Lee KC, Koh D, Lee SS. Increasing the coverage of influenza vaccination in healthcare workers: review of challenges and solutions. The Journal of Hospital Infection. October 2016, s. 133–42. DOI 10.1016/j.jhin.2016.07.003. PMID 27546456.
- ↑ a b c d Rubin GJ, Potts HW, Michie S. Likely uptake of swine and seasonal flu vaccines among healthcare workers. A cross-sectional analysis of UK telephone survey data. Vaccine. March 2011, s. 2421–28. DOI 10.1016/j.vaccine.2011.01.035. PMID 21277402.
- ↑ Seasonal Flu Shot [online]. December 9, 2019 [cit. 2020-01-12]. Dostupné online.
- ↑ Vaccine use [online]. World Health Organization (WHO) [cit. 2017-01-15]. Dostupné v archivu pořízeném z originálu dne December 15, 2012.
- ↑ a b c Influenza (Seasonal) Fact sheet [online]. World Health Organization (WHO), November 2016 [cit. 2017-01-15]. Dostupné v archivu pořízeném z originálu dne November 30, 2014.
- ↑ Recommendations on influenza vaccination during the 2019–2020 winter season [online]. September 24, 2019 [cit. 2019-10-14]. Dostupné online.
- ↑ a b Archivovaná kopie. www.canada.ca [online]. [cit. 2021-11-22]. Dostupné v archivu pořízeném z originálu dne 2020-07-16.
- ↑ Risk groups for severe influenza [online]. [cit. 2019-10-22]. Dostupné v archivu pořízeném z originálu dne October 22, 2019.
- ↑ ECDC Reviews – New WHO recommendations on seasonal influenza .... European Centre for Disease Prevention and Control (ECDC). Dostupné v archivu pořízeném z originálu dne May 10, 2017.
- ↑ ECDC Guidance: Priority risk groups for influenza vaccination [online]. European Centre for Disease Prevention and Control (ECDC) [cit. 2016-12-25]. S. 7–8. Dostupné v archivu pořízeném z originálu dne December 25, 2016.
- ↑ a b c Children & Influenza (Flu) [online]. U.S. Centers for Disease Control and Prevention (CDC), October 23, 2019. Dostupné v archivu pořízeném z originálu dne November 11, 2019.
- ↑ Live Attenuated Influenza Vaccine [LAIV] (The Nasal Spray Flu Vaccine) [online]. September 16, 2019 [cit. 2019-10-14]. Dostupné v archivu pořízeném z originálu dne October 14, 2019.
- ↑ Influenza Vaccination: A Summary for Clinicians – Health Professionals – Seasonal Influenza (Flu) [online]. U.S. Centers for Disease Control and Prevention (CDC), September 6, 2018. Dostupné v archivu pořízeném z originálu dne February 24, 2008.
- ↑ a b Fluzone, Fluzone High-Dose and Fluzone Intradermal [online]. July 11, 2017 [cit. 2020-06-01]. Dostupné v archivu pořízeném z originálu dne July 22, 2017.
- ↑ Lee JK, Lam GK, Shin T, Kim J, Krishnan A, Greenberg DP, Chit A. Efficacy and effectiveness of high-dose versus standard-dose influenza vaccination for older adults: a systematic review and meta-analysis. Expert Rev Vaccines. May 2018, s. 435–443. DOI 10.1080/14760584.2018.1471989. PMID 29715054. S2CID 21688517.
- ↑ Robertson CA, DiazGranados CA, Decker MD, Chit A, Mercer M, Greenberg DP. Fluzone High-Dose Influenza Vaccine. Expert Rev Vaccines. December 2016, s. 1495–1505. DOI 10.1080/14760584.2016.1254044. PMID 27813430.
- ↑ An Advisory Committee Review National Advisory Committee on Immunization (NACI) [online]. Public Health Agency of Canada [cit. 2022-01-04]. Dostupné online.
- ↑ TANNER, Lindsey. Hospitals crack down on workers who refuse flu shots [online]. NBC News, January 13, 2013 [cit. 2014-07-24]. Dostupné v archivu pořízeném z originálu dne December 3, 2013.
- ↑ ((Centers for Disease Control Prevention (CDC))). Seasonal influenza and 2009 H1N1 influenza vaccination coverage among pregnant women – 10 states, 2009–10 influenza season. Morbidity and Mortality Weekly Report (MMWR). December 2010, s. 1541–45. Dostupné v archivu pořízeném z originálu dne June 25, 2017. PMID 21124293.
- ↑ a b ALTMAN, Lawrence K. Panel Advises Flu Shots for Children Up to Age 18. The New York Times. February 28, 2008. Dostupné v archivu pořízeném z originálu dne January 22, 2015.
- ↑ U.S. Centers for Disease Control and Prevention (CDC): ACIP votes down use of LAIV for 2016–2017 flu season, tisková zpráva, [cit. {{{accessdate}}}], Dostupné on-line.
- ↑ Immunization Schedules [online]. U.S. Centers for Disease Control and Prevention (CDC) [cit. 2014-11-04]. Dostupné v archivu pořízeném z originálu dne November 5, 2014.
- ↑ Getting flu with Covid makes you twice as likely to die, says UK health chief The Guardian
- ↑ Flu vaccine FAQs [online]. Healthdirect, Department of Health, Government of Australia, April 1, 2019 [cit. 2019-05-29]. Dostupné online.
- ↑ Influenza fact sheet [online]. Healthdirect, Department of Health, Government of Australia, April 1, 2019 [cit. 2019-05-29]. Dostupné online.
- ↑ Health care use – Influenza vaccination rates – OECD Data [online]. [cit. 2020-04-24]. Dostupné online.
- ↑ a b Han YK, Michie S, Potts HW, Rubin GJ. Predictors of influenza vaccine uptake during the 2009/10 influenza A H1N1v ('swine flu') pandemic: Results from five national surveys in the United Kingdom. Preventive Medicine. March 2016, s. 57–61. DOI 10.1016/j.ypmed.2015.12.018. PMID 26757401.
- ↑ Bish A, Yardley L, Nicoll A, Michie S. Factors associated with uptake of vaccination against pandemic influenza: a systematic review. Vaccine. September 2011, s. 6472–84. DOI 10.1016/j.vaccine.2011.06.107. PMID 21756960.
- ↑ Brien S, Kwong JC, Buckeridge DL. The determinants of 2009 pandemic A/H1N1 influenza vaccination: a systematic review. Vaccine. February 2012, s. 1255–64. DOI 10.1016/j.vaccine.2011.12.089. PMID 22214889.
- ↑ Thomas RE, Lorenzetti DL. Interventions to increase influenza vaccination rates of those 60 years and older in the community. The Cochrane Database of Systematic Reviews. May 2018, s. CD005188. DOI 10.1002/14651858.CD005188.pub4. PMID 29845606.
- ↑ ((Centers for Disease Control Prevention (CDC))). Update on influenza A (H1N1) 2009 monovalent vaccines. Morbidity and Mortality Weekly Report (MMWR). October 2009, s. 1100–01. Dostupné v archivu pořízeném z originálu dne June 29, 2011. PMID 19816398.
- ↑ La Torre G, Di Thiene D, Cadeddu C, Ricciardi W, Boccia A. Behaviours regarding preventive measures against pandemic H1N1 influenza among Italian healthcare workers, October 2009. Euro Surveillance. December 2009. PMID 20003908.
- ↑ Amodio E, Anastasi G, Marsala MG, Torregrossa MV, Romano N, Firenze A. Vaccination against the 2009 pandemic influenza A (H1N1) among healthcare workers in the major teaching hospital of Sicily (Italy). Vaccine. February 2011, s. 1408–12. DOI 10.1016/j.vaccine.2010.12.041. PMID 21199700.
- ↑ Chor JS, Ngai KL, Goggins WB, Wong MC, Wong SY, Lee N, Leung TF, Rainer TH, Griffiths S, Chan PK. Willingness of Hong Kong healthcare workers to accept pre-pandemic influenza vaccination at different WHO alert levels: two questionnaire surveys. BMJ. August 2009, s. b3391. DOI 10.1136/bmj.b3391. PMID 19706937.
- ↑ SCHNIRRING, Lisa. CDC updates flu vaccination recommendations [online]. August 18, 2011 [cit. 2019-10-24]. Dostupné v archivu pořízeném z originálu dne October 25, 2019.
- ↑ ((Centers for Disease Control Prevention (CDC))). Influenza vaccination coverage among health-care personnel – United States, 2010–11 influenza season. Morbidity and Mortality Weekly Report (MMWR). August 2011, s. 1073–77. Dostupné v archivu pořízeném z originálu dne May 25, 2017. PMID 21849963.
- ↑ ((Centers for Disease Control Prevention (CDC))). Influenza vaccination coverage among health-care personnel: 2011–12 influenza season, United States. Morbidity and Mortality Weekly Report (MMWR). September 2012, s. 753–57. Dostupné v archivu pořízeném z originálu dne June 24, 2017. PMID 23013720.
- ↑ Bull AL, Bennett N, Pitcher HC, Russo PL, Richards MJ. Influenza vaccine coverage among health care workers in Victorian public hospitals. The Medical Journal of Australia. February 2007, s. 185–86. Dostupné online. DOI 10.5694/j.1326-5377.2007.tb00858.x. PMID 17309419. S2CID 25091208.
- ↑ a b c Abbasi J. The Search for a Universal Flu Vaccine Heats Up. JAMA. November 2019, s. 1942–1944. DOI 10.1001/jama.2019.16816. PMID 31693060. S2CID 207903441.
- ↑ a b c GREENFIELDBOYCE, Nell. New and Old Ways to Make Flu Vaccines. [s.l.]: NPR, November 8, 2007. Dostupné v archivu pořízeném z originálu dne October 24, 2019.
- ↑ Influenza Vaccine Strategies for Broad Global Access [online]. October 2007 [cit. 2009-09-16]. Dostupné v archivu pořízeném z originálu dne October 14, 2019.
- ↑ a b how it's made [online]. [cit. 2021-11-22]. Dostupné v archivu pořízeném dne July 5, 2010.
- ↑ Influenza vaccine viruses and reagents [online]. World Health Organization (WHO). Dostupné v archivu pořízeném z originálu dne May 27, 2013.
- ↑ Recommendations for the production and control of influenza vaccine (inactivated) [online]. World Health Organization (WHO) [cit. 2013-05-27]. Dostupné v archivu pořízeném z originálu dne October 28, 2013.
- ↑ a b RACANIELLO, Vincent. Influenza virus growth in eggs [online]. Virology Blog, Dec 2009. Dostupné v archivu pořízeném z originálu dne December 25, 2014.
- ↑ IZZAT, Fakhrul. Viral Cultivation in Chicken Embryo [online]. Youtube, Apr 2012. Dostupné v archivu pořízeném z originálu dne May 26, 2015.
- ↑ a b How Influenza (Flu) Vaccines Are Made [online]. U.S. Centers for Disease Control and Prevention (CDC), November 26, 2019 [cit. 2019-12-02]. Dostupné v archivu pořízeném z originálu dne December 2, 2019.
- ↑ Bright RA, Carter DM, Daniluk S, Toapanta FR, Ahmad A, Gavrilov V, Massare M, Pushko P, Mytle N, Rowe T, Smith G, Ross TM. Influenza virus-like particles elicit broader immune responses than whole virion inactivated influenza virus or recombinant hemagglutinin. Vaccine. May 2007, s. 3871–78. DOI 10.1016/j.vaccine.2007.01.106. PMID 17337102.
- ↑ Priming with DNA vaccine makes avian flu vaccine work better (NIH News) [online]. October 3, 2011. Dostupné v archivu pořízeném z originálu dne September 27, 2012.
- ↑ NATIONAL INSTITUTE OF ALLERGY AND INFECTIOUS DISEASES (NIAID). An Open-Label, Randomized Phase I Study in Healthy Adults of 4 Prime-Boost Schedules With Monovalent Influenza Subunit Virion (H5N1) Vaccine (Sanofi Pasteur, Inc), Administered Alone or Following Recombinant DNA Plasmid (H5) Vaccine (VRC, NIAID). [s.l.]: [s.n.] Dostupné online. Submitted: October 18, 2008.
- ↑ NATIONAL INSTITUTE OF ALLERGY AND INFECTIOUS DISEASES (NIAID). VRC 310: An Open-Label, Randomized Ph I: Healthy Adults of Prime-Boost Intervals w/Monovalent Influenza Virion (H5N1) Vaccine, A/Indonesia/05/2005 (Sanofi Pasteur, Inc), Administered Alone or Following Recombinant H5 DNA Vaccine. [s.l.]: [s.n.] Dostupné online. Submitted: March 12, 2010.
- ↑ a b RESEARCH, Center for Biologics Evaluation and. Approved Products – November 20, 2012 Approval Letter – Flucelvax [online]. U.S. Food and Drug Administration (FDA). Dostupné v archivu pořízeném z originálu dne December 3, 2012.
- ↑ a b Seqirus: Seqirus receives FDA approval for Flucelvax Quadrivalent (Influenza Vaccine) for people four years of age and older, tisková zpráva, [cit. {{{accessdate}}}], Dostupné on-line. Archivovaná kopie. www.seqirus.com [online]. [cit. 2021-11-22]. Dostupné v archivu pořízeném z originálu dne 2017-01-16.
- ↑ a b ROOS, Robert. FDA approves first flu vaccine grown in insect cells [online]. October 14, 2019 [cit. 2019-10-14]. Dostupné v archivu pořízeném z originálu dne October 14, 2019.
- ↑ a b Flublok [online]. February 26, 2018 [cit. 2019-10-14]. Dostupné v archivu pořízeném z originálu dne October 14, 2019. STN 125285.
- ↑ a b Flublok Quadrivalent [online]. August 2, 2019 [cit. 2019-10-14]. Dostupné v archivu pořízeném z originálu dne October 14, 2019. STN 125285.
- ↑ a b c Supemtek: Pending EC decision [online]. September 17, 2020 [cit. 2020-09-21]. Dostupné online.
- ↑ Postma MJ, Baltussen RP, Palache AM, Wilschut JC. Further evidence for favorable cost-effectiveness of elderly influenza vaccination. Expert Review of Pharmacoeconomics & Outcomes Research. April 2006, s. 215–27. DOI 10.1586/14737167.6.2.215. PMID 20528557. S2CID 12765724.
- ↑ Newall AT, Kelly H, Harsley S, Scuffham PA. Cost effectiveness of influenza vaccination in older adults: a critical review of economic evaluations for the 50- to 64-year age group. PharmacoEconomics. 2009, s. 439–50. DOI 10.2165/00019053-200927060-00001. PMID 19640008. S2CID 20855671.
- ↑ Newall AT, Viboud C, Wood JG. Influenza-attributable mortality in Australians aged more than 50 years: a comparison of different modelling approaches. Epidemiology and Infection. June 2010, s. 836–42. Dostupné online. DOI 10.1017/S095026880999118X. PMID 19941685. S2CID 29939376.
- ↑ Newall AT, Dehollain JP, Creighton P, Beutels P, Wood JG. Understanding the cost-effectiveness of influenza vaccination in children: methodological choices and seasonal variability. PharmacoEconomics. August 2013, s. 693–702. DOI 10.1007/s40273-013-0060-7. PMID 23645539. S2CID 8616720.
- ↑ Newall AT, Scuffham PA. Uncertainty and variability in influenza cost-effectiveness models. Australian and New Zealand Journal of Public Health. December 2011, s. 576; author reply 576–77. DOI 10.1111/j.1753-6405.2011.00788.x. PMID 22151168. S2CID 22402257.
- ↑ Gatwood J, Meltzer MI, Messonnier M, Ortega-Sanchez IR, Balkrishnan R, Prosser LA. Seasonal influenza vaccination of healthy working-age adults: a review of economic evaluations. Drugs. January 2012, s. 35–48. DOI 10.2165/11597310-000000000-00000. PMID 22191794. S2CID 46305863.
- ↑ Newall AT, Jit M, Beutels P. Economic evaluations of childhood influenza vaccination: a critical review. PharmacoEconomics. August 2012, s. 647–60. DOI 10.2165/11599130-000000000-00000. PMID 22788257. S2CID 38289883.
- ↑ Newall AT, Wood JG, Oudin N, MacIntyre CR. Cost-effectiveness of pharmaceutical-based pandemic influenza mitigation strategies. Emerging Infectious Diseases. February 2010, s. 224–30. DOI 10.3201/eid1602.090571. PMID 20113551.
- ↑ Influenza Genome Sequencing Project – Overview [online]. National Institutes of Health – National Institute of Allergy and Infectious Diseases [cit. 2013-05-27]. Dostupné v archivu pořízeném z originálu dne June 27, 2011.
- ↑ Lampos V, Yom-Tov E, Pebody R, Cox IJ. Assessing the impact of a health intervention via user-generated Internet content. Data Mining and Knowledge Discovery. 2015, s. 1434–57. Dostupné online. DOI 10.1007/s10618-015-0427-9. S2CID 215415165.
- ↑ Wagner M, Lampos V, Yom-Tov E, Pebody R, Cox IJ. Estimating the Population Impact of a New Pediatric Influenza Vaccination Program in England Using Social Media Content. Journal of Medical Internet Research. December 2017, s. e416. DOI 10.2196/jmir.8184. PMID 29269339.
- ↑ Acute Respiratory Infections (Update September 2009) [online]. World Health Organization (WHO), September 2009 [cit. 2009-09-16]. Dostupné v archivu pořízeném z originálu dne September 29, 2009.
- ↑ Tables on the Clinical trials of pandemic influenza prototype vaccines [online]. World Health Organization (WHO), July 2009 [cit. 2009-09-21]. Dostupné v archivu pořízeném z originálu dne March 6, 2009.
- ↑ FDA Approves Vaccines for 2009 H1N1 Influenza Virus. web.archive.org [online]. 2009-10-15 [cit. 2021-11-20]. Dostupné v archivu pořízeném z originálu dne 2009-10-15.
- ↑ KEOWN, Alex. FDA Approves Seqirus' Audenz as Vaccine Against Potential Flu Pandemic [online]. February 4, 2020 [cit. 2020-02-05]. Dostupné online.
- ↑ Audenz [online]. January 31, 2020 [cit. 2020-02-05]. Dostupné online. STN: 125692.
- ↑ a b c Cho A, Wrammert J. Implications of broadly neutralizing antibodies in the development of a universal influenza vaccine. Current Opinion in Virology. April 2016, s. 110–115. DOI 10.1016/j.coviro.2016.03.002. PMID 27031684.
- ↑ OCUNO, Y. A common neutralizing epitope conserved between the hemagglutinins of influenza A virus H1 and H2 strains.. Journal of Virology. May 1993, s. 2552–58. DOI 10.1128/JVI.67.5.2552-2558.1993. PMID 7682624.
- ↑ a b c d Soema PC, Kompier R, Amorij JP, Kersten GF. Current and next generation influenza vaccines: Formulation and production strategies. European Journal of Pharmaceutics and Biopharmaceutics. August 2015, s. 251–63. DOI 10.1016/j.ejpb.2015.05.023. PMID 26047796.
- ↑ Deng L, Cho KJ, Fiers W, Saelens X. M2e-Based Universal Influenza A Vaccines. Vaccines. February 2015, s. 105–36. DOI 10.3390/vaccines3010105. PMID 26344949.
- ↑ Gottlieb T, Ben-Yedidia T. Epitope-based approaches to a universal influenza vaccine. Journal of Autoimmunity. November 2014, s. 15–20. DOI 10.1016/j.jaut.2014.07.005. PMID 25172355.
- ↑ Toussi DN, Massari P. Immune Adjuvant Effect of Molecularly-defined Toll-Like Receptor Ligands. Vaccines. April 2014, s. 323–53. DOI 10.3390/vaccines2020323. PMID 26344622.
- ↑ Atsmon J, Caraco Y, Ziv-Sefer S, Shaikevich D, Abramov E, Volokhov I, Bruzil S, Haima KY, Gottlieb T, Ben-Yedidia T. Priming by a novel universal influenza vaccine (Multimeric-001)-a gateway for improving immune response in the elderly population. Vaccine. October 2014, s. 5816–23. DOI 10.1016/j.vaccine.2014.08.031. PMID 25173483.
- ↑ van Doorn E, Liu H, Ben-Yedidia T, Hassin S, Visontai I, Norley S, Frijlink HW, Hak E. Evaluating the immunogenicity and safety of a BiondVax-developed universal influenza vaccine (Multimeric-001) either as a standalone vaccine or as a primer to H5N1 influenza vaccine: Phase IIb study protocol. Medicine (Baltimore). March 2017, s. e6339. DOI 10.1097/MD.0000000000006339. PMID 28296763.
- ↑ NATIONAL INSTITUTE OF ALLERGY AND INFECTIOUS DISEASES (NIAID). A Phase II, Double-Blind, Multicenter, Randomized, Placebo-Controlled Trial to Assess the Safety, Reactogenicity and Immunogenicity of Two Doses of Multimeric-001 (M-001) Followed by Seasonal Quadrivalent Influenza Vaccine. [s.l.]: [s.n.] Dostupné online. Submitted: February 9, 2017.
- ↑ BIONDVAX PHARMACEUTICALS LTD. A Pivotal Multi-center, Randomized, Modified Double-blind, Placebo-controlled Phase 3 Trial to Assess the Safety and Clinical Efficacy of M-001 Influenza Vaccine Administered Intra-muscularly Twice in Older Adults and Elderly (≥50 Years).. [s.l.]: [s.n.] Dostupné online. Submitted: February 8, 2018.
- ↑ PHILLIPSON, Josh. BiondVax Announces Topline Results from Phase 3 Clinical Trial of the M-001 Universal Influenza Vaccine Candidate [online]. BiondVax. Dostupné online.
- ↑ a b NIH begins first-in-human trial of a universal influenza vaccine candidate [online]. April 3, 2019 [cit. 2019-11-12]. Dostupné v archivu pořízeném z originálu dne November 12, 2019.
- ↑ SEDERSTROM, Jill. Researchers Exploring Oral Flu Vaccine and Treatment Options [online]. Drug Topics, July 19, 2019 [cit. 2020-01-27]. Dostupné online.
- ↑ FAST, Patricia E; COX, Josephine H. An influenza vaccine pill-can we swallow it?. The Lancet Infectious Diseases. September 1, 2015, s. 1051–6; discussion 1056–57. Dostupné online [cit. January 27, 2020]. DOI 10.1016/s1473-3099(15)00252-2. PMID 2633331.
- ↑ LIEBOWITZ, David; GOTTLIEB, Keith; KOLHATKAR, Nikita S; GARG, Shaily J; ASHER, Jason M; NAZARENO, Jonathan. Efficacy, immunogenicity, and safety of an oral influenza vaccine: a placebo-controlled and active-controlled phase 2 human challenge study. The Lancet Infectious Diseases. Elsevier, January 21, 2020, s. 435–444. Dostupné online [cit. January 27, 2020]. DOI 10.1016/S1473-3099(19)30584-5. PMID 31978354. S2CID 210892802.
- ↑ Influenza Report (online book) Archivováno 10. 5. 2016 na Wayback Machine. chapter Avian Influenza by Timm C. Harder and Ortrud Werner
- ↑ equiflunet_vaccines. 195.224.162.216 [online]. [cit. 2021-11-22]. Dostupné v archivu pořízeném dne 2006-01-10.
- ↑ UAE Equestrian & Racing Federation [online]. March 22, 2005. Dostupné v archivu pořízeném z originálu dne March 22, 2005.
- ↑ FEI guidelines [online]. Dostupné v archivu pořízeném z originálu dne October 26, 2007.
- ↑ MCNEIL, Donald G. Jr. Turning to Chickens in Fight With Bird Flu. The New York Times. May 2, 2006. Dostupné v archivu pořízeném z originálu dne November 14, 2012.
- ↑ Bird flu warning over partial protection of flocks [online]. August 16, 2006 [cit. 2021-11-22]. Dostupné v archivu pořízeném dne September 26, 2007.
- ↑ FAO Recommendations on the Prevention, Control and Eradication of Highly Pathogenic Avian Influenza (HPAI) in Asia [online]. [cit. 2021-11-22]. Dostupné v archivu pořízeném dne February 2, 2010.
- ↑ Yen HL, Peiris JS. Virology: bird flu in mammals. Nature. May 2012, s. 332–33. DOI 10.1038/nature11192. PMID 22722190. S2CID 205229301. Bibcode 2012Natur.486..332Y.
- ↑ Swine Flu Virus Turns Endemic [online]. September 15, 2007. Dostupné v archivu pořízeném z originálu dne April 29, 2009.
- ↑ Custom Vaccines: Swine [online]. [cit. 2021-11-22]. Dostupné v archivu pořízeném dne April 30, 2009.
- ↑ Karaca K, Dubovi EJ, Siger L, Robles A, Audonnet JC, Jiansheng Y, Nordgren R, Minke JM. Evaluation of the ability of canarypox-vectored equine influenza virus vaccines to induce humoral immune responses against canine influenza viruses in dogs. American Journal of Veterinary Research. February 2007, s. 208–12. DOI 10.2460/ajvr.68.2.208. PMID 17269888.
- ↑ Global Influenza Surveillance and Response System (GISRS) [online]. World Health Organization [cit. 2019-10-22]. Dostupné online.
- ↑ Spotlight: Influenza [online]. World Health Organization [cit. 2019-10-22]. Dostupné online.
- ↑ Global influenza surveillance [online]. Dostupné v archivu pořízeném z originálu dne April 30, 2003.
- ↑ BROWN, David. Keeping ahead of flu comes down to guessing game. Knoxville News Sentinel. February 18, 2008. Dostupné v archivu pořízeném z originálu dne January 11, 2009.
- ↑ ((World Health Organization)). WHO Report on Global Surveillance of Epidemic-prone Infectious Diseases – Influenza. [s.l.]: World Health Organization (WHO), 2000. WHO/CDS/CSR/ISR/2000/1.
- ↑ Grohskopf LA, Sokolow LZ, Broder KR, Walter EB, Bresee JS, Fry AM, Jernigan DB. Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices – United States, 2017–18 Influenza Season. MMWR. Recommendations and Reports. August 2017, s. 1–20. Dostupné online. DOI 10.15585/mmwr.rr6602a1. PMID 28841201.
- ↑ a b WHO switches H1N1 in Southern Hemisphere flu vaccine [online]. September 29, 2016 [cit. 2017-09-12]. Dostupné online.
- ↑ KARLAMANGLA, Soumya. Severe flu brings medicine shortages, packed ERs and a rising death toll in California. Los Angeles Times. January 6, 2018. Dostupné online [cit. January 7, 2018].
- ↑ SUN, Lena H. This season's flu vaccine is only 36 percent effective, but experts say you should still get it. The Washington Post. February 15, 2018. Dostupné online [cit. February 17, 2018].
- ↑ Flannery B, Chung JR, Belongia EA, McLean HQ, Gaglani M, Murthy K, Zimmerman RK, Nowalk MP, Jackson ML, Jackson LA, Monto AS, Martin ET, Foust A, Sessions W, Berman L, Barnes JR, Spencer S, Fry AM. Interim Estimates of 2017–18 Seasonal Influenza Vaccine Effectiveness – United States, February 2018. MMWR. Morbidity and Mortality Weekly Report. February 2018, s. 180–85. Dostupné online. DOI 10.15585/mmwr.mm6706a2. PMID 29447141.
- ↑ a b ((World Health Organization)). Recommended composition of influenza virus vaccines for use in the 2018 southern hemisphere influenza season. Wkly. Epidemiol. Rec.. October 2017, s. 625–33. PMID 29052409.
- ↑ Recommended composition of influenza virus vaccines for use in the 2018 southern hemisphere influenza season [online]. World Health Organization (WHO), September 28, 2017 [cit. 2017-09-28]. Dostupné online.
- ↑ a b ((World Health Organization)). Recommended composition of influenza virus vaccines for use in the 2018–2019 northern hemisphere influenza season. Wkly. Epidemiol. Rec.. March 2018, s. 133–41. PMID 29569429.
- ↑ ((World Health Organization)). Review of the 2018–2019 influenza season in the northern hemisphere. Wkly. Epidemiol. Rec.. 2019, s. 345–63.
- ↑ Recommended composition of influenza virus vaccines for use in the 2018–2019 northern hemisphere influenza season [online]. World Health Organization (WHO), February 22, 2018 [cit. 2018-09-12]. Dostupné online.
- ↑ a b Influenza Virus Vaccine for the 2018–2019 Season [online]. November 8, 2018 [cit. 2019-12-09]. Dostupné v archivu pořízeném z originálu dne December 10, 2019.
- ↑ a b ((World Health Organization)). Recommended composition of influenza virus vaccines for use in the 2019 southern hemisphere influenza season. Wkly. Epidemiol. Rec.. 2018, s. 553–62.
- ↑ Standardization of terminology of the pandemic A(H1N1) 2009 virus [online]. World Health Organization (WHO) [cit. 2012-06-14]. Dostupné online.
- ↑ Recommended composition of influenza virus vaccines for use in the 2019–2020 northern hemisphere influenza season [online]. World Health Organization (WHO) [cit. 2019-03-22]. Dostupné online.
- ↑ a b Influenza Vaccine for the 2019-2020 Season [online]. December 5, 2019 [cit. 2019-12-09]. Dostupné v archivu pořízeném z originálu dne December 10, 2019.
- ↑ Vaccines and Related Biological Products Advisory Committee March 6–7, 2019 Meeting Announcement [online]. March 6–7, 2019 [cit. 2019-12-09]. Dostupné v archivu pořízeném z originálu dne December 10, 2019.
- ↑ Vaccines and Related Biological Products Advisory Committee March 22, 2019 Meeting Announcement [online]. March 22, 2019 [cit. 2019-12-09]. Dostupné v archivu pořízeném z originálu dne December 10, 2019.
- ↑ a b EU recommendations for 2019/2020 seasonal flu vaccine composition [online]. May 15, 2019 [cit. 2019-12-09]. Dostupné v archivu pořízeném z originálu dne December 10, 2019.
- ↑ a b ((World Health Organization)). Recommended composition of influenza virus vaccines for use in the 2020 southern hemisphere influenza season. Wkly. Epidemiol. Rec.. October 18, 2019, s. 473–84.
- ↑ a b Recommended composition of influenza virus vaccines for use in the 2020–2021 northern hemisphere influenza season [online]. February 28, 2020 [cit. 2020-08-25]. Dostupné online.
- ↑ a b c Influenza Vaccine for the 2020-2021 Season [online]. July 10, 2020 [cit. 2020-07-12]. Dostupné online.
- ↑ a b c d EU recommendations for 2020/2021 seasonal flu vaccine composition [online]. April 1, 2020. Dostupné online.
- ↑ Recommended composition of influenza virus vaccines for use in the 2021 southern hemisphere influenza season [online]. September 25, 2020 [cit. 2021-04-29]. Dostupné online.
- ↑ Flu vaccine [online]. [cit. 2021-04-29]. Dostupné online.
- ↑ a b c d EU recommendations for 2021/2022 seasonal flu vaccine composition [online]. March 30, 2021. Dostupné online.
- ↑ Archivovaná kopie. www.ema.europa.eu [online]. [cit. 2021-11-22]. Dostupné v archivu pořízeném z originálu dne 2021-06-30.
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Vakcína proti chřipce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Vakcína proti chřipce na Wikimedia Commons
