Slintavka a kulhavka

Slintavka a kulhavka (SLAK) (anglicky: Foot and Mouth Disease (FMD), latinsky: Aphtae epizooticae) je akutní vysoce nakažlivé virové onemocnění sudokopytníků charakterizované horečkou, tvorbou typických puchýřů a aft na sliznici dutiny ústní, na mulci, nozdrách a spárcích. Onemocnění způsobuje virus slintavky a kulhavky, patřící mezi RNA viry z čeledi Picornaviridae. Nejvnímavější k infekci je skot, prase a ovce. Člověk onemocní velice zřídka.
Slintavka a kulhavka je jednou z nejnakažlivějších infekčních chorob na světě. Vylučuje se slinami, močí, trusem, mlékem a přenáší se kontaktem s nemocnými zvířaty, vzduchem (až na vzdálenost 300 km), dále pak mechanicky na povrchu zvířat, člověka, nástrojů či dopravních prostředků. Nemocnost dosahuje 100 %, úmrtnost je u dospělých zvířat nízká (do 5 %).
Hlavním klinickým příznakem jsou puchýře na jazyku, v dutině ústní, na mulci a na končetinách – paznehtech a spárcích. Puchýře během krátké doby nemoci praskají a na jejich místě zůstávají afty, jež mohou být kontaminovány bakteriemi. Pro zvířata jsou tyto léze bolestivé a v důsledku toho dochází k nadměrné tvorbě slin (slinotok), postižená zvířata skřípají zuby, vykazují apatii, nechuť k žrádlu, kulhají a ulehají. Selata, telata, jehňata a kůzlata mohou náhle hynout bez příznaků následkem myokarditidy.
Diagnostika se provádí pomocí metod jako je ELISA, virus neutralizační test, real-time PCR pouze v akreditovaných laboratořích. Terapie se neprovádí a preventivní očkování je zakázáno v celé EU od roku 1992. Pouze ve výjimečných případech při vzniku ohniska a nebezpečí rychlého šíření nákazy je povolena nouzová vakcinace zdravých zvířat kolem ohniska. Onemocnění se vyskytuje endemicky zejména v Asii, Africe a některých zemích Jižní Ameriky. Výskyt nemoci ve vyspělých zemích s vysokou koncentrací hospodářských zvířat může mít velmi dramatický ekonomický i sociální dopad. Příkladem je epidemie slintavky a kulhavky v Západní Evropě v roce 2001, kde bylo zasaženo více než 2000 chovů dobytka, utraceno kolem 5,8 miliónů zvířat. Ztráty při této katastrofě ve Velké Británii dosáhly 13 miliard amerických dolarů, přičemž likvidace nákazy ovlivnila i obyčejné obyvatelstvo Británie.
Historie výzkumu
Zřejmě první písemné zmínky o slintavce a kulhavce se datují do roku 1594, kdy italský filosof a lékař Girolamo Fracastoro popsal příznaky tohoto onemocnění u dobytka. Nelze ovšem vyloučit, že již onemocnění skotu popsané Aristotelem 350 let před naším letopočtem jako mor skotu bylo ve skutečnosti epidemií SLAK.[1] Ačkoliv se o původu SLAK nic nevědělo téměř až do konce 19. století, chovatelé dobytka již věděli jak nákaze alespoň částečně čelit. Šlo o metodu tzv. aftizace, při které se v případě vzplanutí ohniska v chovu vzala tekutina z afty krávy a pomocí štětce se touto tekutinou nakazil všechen dobytek na statku a zvířata v sousedství. Zvířata tak prodělala chorobu najednou, zabránilo se tím cirkulaci viru v prostředí a dotčené statky a celá území se rychleji vypořádaly s nákazou. V Prusku byla dokonce aftizace v roce 1781 uzákoněna. Vzhledem k obrovským ztrátám, jež slintavka působila na území dnešního Německa, vypsal v roce 1893 pruský ministr zemědělství peněžitou odměnu pro toho, kdo objeví příčinu nemoci.[2] To se povedlo až profesorovi Friedrichu Loefflerovi z Greisswaldu a jeho berlínskému kolegovi Paulu Froschovi, kteří v letech 1897–1898 poprvé referovali o viru slintavky a kulhavky.[3][4] Bylo to jen 5 let od publikování prvního objeveného viru – viru tabákové mozaiky.[1] Virus slintavky a kulhavky byl tak vůbec prvním popsaným virem způsobující onemocnění zvířat.[5] V roce 1920 byla popsána možnost experimentálně replikovat virus v morčeti.[6] Dalšího významného posunu bylo dosaženo roku 1922, kdy byla odhalena antigenní variabilita viru, tedy skutečnost, že virus existuje ve více sérotypech. V letech 1928–1932 byly sérotypy vyvíjeny v Rusku, na ostrově Gorodomlja. Mezi první známé sérotypy patřil sérotyp O a A.[7] Následně byl izolován sérotyp C a během 40. let byly v Africe popsány sérotypy SAT1, SAT2, SAT3. Jako poslední byl objeven v roce 1954 v Pákistánu sérotyp Asia-1.[5]
Původce
Původcem slintavky a kulhavky je RNA virus z čeledi Picornaviridae, rodu Aphtovirus. Každá virová částice (virion) viru slintavky a kulhavky (zkratka FMDV) je tvořena molekulou RNA, 4 typy strukturálních proteinů (VP1, VP2, VP3, VP4) a několika dalšími nestrukturálními proteiny.[8] V elektronovém mikroskopu se jeví virion FMDV jako kulatý útvar s hladkým povrchem o velikosti 25 nm.[9] Podobně jako ostatní viry z čeledi Picornaviridae má kapsida ikosahedrický tvar a neobsahuje žádné lipidy.[10] Významnou vlastností FMDV je antigenní a imunologická variabilita, jež spočívá v existenci viru v různých sérotypech a subtypech. Na světě existuje celkem 7 sérotypů, které se označují písmeny dle oblastí, kde byly poprvé identifikovány:
- A (objeven v Německu a název pochází od slova Allemagne = Německo ve francouzském jazyce)[7]
- O (název odvozen dle francouzské oblasti Oise)[7]
- C (objeven jako třetí v pořadí a proto mu bylo přiřazeno třetí písmo abecedy)[11]
- SAT1 (název odvozen od jižní Afriky – South Africa Territory)[12]
- SAT2[12]
- SAT3[12]
- Asia-1 (objeven v Pákistánu)[5]
Tyto sérotypy se dále dělí do několika subtypů. Nejběžnější je sérotyp O, který se vyskytuje po celém světě.[9]
Fyzikálně-chemické vlastnosti viru
Virus slintavky a kulhavky je relativně odolný vůči vnějšímu prostředí.[10] Přežívání viru v prostředí je velmi variabilní a závislé na materiálu, ve kterém je virus lokalizován, na původní koncentraci viru, kmenu viru, vlhkosti, teplotě a hodnotě pH. Virus je schopen přežívat například na seně či slámě až 20 týdnů, až 14 dní na uschlých výkalech, 39 dní v moči, až 6 měsíců v blátě, 3 dny na půdě v létě a 28 dní na půdě na podzim.[13] Virus je daleko odolnější ve tkáních než ve vnějším prostředí.[10] Teploty nad 50 °C virus zcela inaktivují, při chladničkové teplotě a teplotě pod bodem mrazu virus přežívá. Pokud jde o pH, virus je schopen přežívat při pH od 6 do 9.[14] Při zrání masa, kdy pH klesá díky biochemickým procesům ve svalové tkáni pod pH 6,0, se virus zcela inaktivuje.[10] Virus FMDV naopak přežívá v kostech a lymfatických uzlinách poražených infikovaných zvířat. Při nedostatečném poklesu pH při zrání masa může rovněž přežívat.[14] V mléce z infikovaných krav je virus překvapivě chráněn vůči vyšším teplotám, pasterizace mléka nebo UHT ohřev však virus bezpečně zničí. Při výrobě sýrů chrání virus v mléce mléčný tuk i při poklesu pH.[10]
Epidemiologie
Slintavka a kulhavka je jednou z nejvíce nakažlivých chorob zvířat a lidí na světě vůbec, což je dáno zejména rychlou replikací viru v hostiteli a přenosu viru ve formě aerosolu.[8]
Hostitel

K onemocnění jsou vnímaví prakticky všichni sudokopytníci, a to především skot, ovce, koza, prase domácí, jak, buvol, dále pak všichni volně žijící zástupci čeledi turovitých (např. muflon, antilopa, pakůň), jelenovitých (např. jelen, srnec, daněk), žirafovitých (např. žirafa, okapi), prasatovitých (např. prase divoké, prase bradavičnaté). Velbloudovití (např. velbloud, lama, alpaka) vykazují velmi nízkou vnímavost vůči viru.[14] Obecně platí, že domácí sudokopytníci jsou vnímavější k nemoci než volně žijící zvířata a dále volně žijící sudokopytníci se daleko častěji nakazí od domácích zvířat.[15] Výjimku představuje buvol africký (Syncerus caffer), jenž je významným zdrojem viru slintavky a kulhavky pro dobytek v Africe.[16][17] Lichokopytníci nejsou k onemocnění vnímaví.[10] Z jiných zvířat než sudokopytníků byl potvrzen výskyt SLAK ve volné přírodě například u slona.[18] V laboratoři byli experimentálně infikovány myši, potkani a drůbež, avšak předpokládá se, že tyto druhy se v přirozených podmínkách nenakazí a mohou hrát pouze roli mechanického přenašeče (viz kapitola přenos).[19] Člověk může také onemocnět slintavkou, nicméně výskyt nemoci u člověka je extrémně vzácný. Člověk se může nakazit pitím nepasterizovaného kontaminovaného mléka, nebo přímým kontaktem s nemocným zvířetem, případně při práci s virem v laboratoři.[10]
Přenos
SLAK se přenáší přímým kontaktem s nemocným zvířetem a nepřímo přes kontaminované sekrety, exkrety, živé či neživé vektory (přenašeče) nebo vzduchem.[19] Živé vektory mohou být všechna zvířata, včetně člověka, která přenášejí virus mechanicky, tzn. virus je ukryt v jejich nebo na povrchu jejich těla, aniž by se množil. Z epizootologického hlediska hrají významnou roli zejména ptáci, potulní psi a kočky.[13] Volně žijící spárkatá zvěř sice představuje potenciální riziko pro chovaný dobytek,[20] nicméně kupříkladu ve Velké Británii nebyl nikdy prokázán přenos SLAK z jelenovitých na domácí zvířata.[21] Navíc se u jelenovitých neprokázalo dlouhodobější vylučování viru.[22] Dalším významným přenašečem viru je člověk.[13] Virus může lidem ulpívat na kůži (dlaně, za nehty), na oblečení nebo na botách. Rovněž vybavení farem (nářadí) kontaminované virem nebo kontaminovaná kola a podvozky aut se podílejí na přenosu SLAK.[19] Vzduchem se SLAK přenáší ve formě aerosolu na vzdálenost až 60 km nad pevninou a až 300 km nad mořem.[14] Přenos viru je samozřejmě velmi ovlivněn aktuálními klimatickými poměry.[13]
Zdroje nákazy
Hlavním zdrojem jsou především infikovaná zvířata, a to jak klinicky nemocná, tak zvířata v inkubační době (tzn. zatím bez klinických projevů SLAK). Je to dáno tím, že virus se vylučuje všemi sekrety a exkrety již 2–3 dny před propuknutím klinických příznaků. Virus FMDV lze nalézt ve vydechovaném vzduchu infikovaných zvířat, v moči, trusu, slinách, mléku a spermatu.[13][23] Zdrojem viru mohou být také tzv. „trvalí nosiči“,[14] kteří jsou definováni jako zvířata, u kterých se virus vylučuje i po 28. dni infekce a později.[24] U buvolů v Africe bylo prokázáno, že někteří jedinci mohou vylučovat FMDV až po dobu 5 let.[25] Aerosol obsahující virové partikule FMDV je nejvýznamnějším zdrojem infekce pro skot, ovce a kozy.[8] Uvádí se, že nejvíce aerosolu vyprodukují infikovaná prasata, poté skot a ovce.[8][19] Na druhou stranu skot nakažený slintavkou a kulhavkou vyprodukuje nejvíce viru FMDV ze všech druhů a je tak považován za dominantní zdroj kontaminace prostředí.[2] Pro názornost: jedna kráva během prvního týdne nemoci kontaminuje svými exkrety (sliny, moč, trus, tekutina z prasklých aft) prostředí více než jednou miliardou infekčních jednotek.[2] Maso a masné výrobky pocházející z infikovaných zvířat jsou dalším významným zdrojem viru, ale pouze v případě, pokud pH v mase nekleslo pod 6,0 nebo masné výrobky nebyly tepelně opracovány.[14]
Výskyt

Slintavka a kulhavka je rozšířena téměř po celém světě,[19] přičemž k rapidnímu globálnímu šíření došlo zejména po 2. světové válce.[26] V současné době se SLAK vyskytuje endemicky především na Středním východě, v Africe, některých částech Asie a v Jižní Americe.[14] Světová organizace pro zdraví zvířat (OIE, anglicky The World Organisation for Animal Health) dělí země dle výskytu SLAK do třech kategorií: 1. státy prosté SLAK bez vakcinace, 2. státy prosté SLAK s použitím vakcinace, 3. státy s výskytem SLAK.[27] Každá kategorie je přesně definována a toto dělení má zásadní vliv na mezinárodní obchod s živými zvířaty a živočišnými produkty.
Jedinou zemí, kde slintavka nebyla nikdy hlášena, je Nový Zéland. Mezi oblasti, kde se nemoc nevyskytla již řadu let, patří Austrálie, Severní a Střední Amerika. Například v Severní Americe byla slintavka a kulhavka naposledy hlášena v roce 1929 v USA, 1952 v Kanadě a v roce 1954 v Mexiku.[19] Na území České republiky byla slintavka a kulhavka naposledy diagnostikována v roce 1975.[28]
Vývoj v Evropě
Onemocnění se do Evropy dostalo jako řada jiných chorob ze Středního východu nebo ze severní Afriky, přičemž nejčastěji epidemie vstupují na evropský kontinent přes Turecko či Rusko, ze Severní Afriky pak přes balkánské země a Itálii.[2][29] Během velké pandemie v letech 1937–1939, jež propukla ve Francii, bylo v této zemi zaznamenáno 378 000 ohnisek, 700 000 ohnisek v Německu, 265 000 v Nizozemsku, 240 000 v Československu, v Polsku 234 000 a v Belgii 102 000 ohnisek.[30] Během této pandemie byla v Německu poprvé testována inaktivovaná vakcína proti SLAK vyvinutá panem Waldmannem. Poslední rozsáhlá pandemie ve 20. století, jež byla způsobena na evropské poměry do té doby neznámým subtypem A5, zasáhla Evropu v letech 1951–1952.[2] Primární ohniska této pandemie byly v oblasti Porýní, odkud se postupně nemoc rozšířila do celé Evropy. Mezi postiženými státy byla Itálie, Spolková republika Německo, Nizozemsko, Belgie, Řecko a Dánsko. Ztráty si dle údajů FAO vyžádaly okolo 600 miliónů amerických dolarů, ale reálný ekonomický dopad byl zřejmě v důsledku selhání ochranné vakcinace daleko vyšší.[29] Po této události byla během 50. let ve většině evropských států zahájena plošná vakcinace mající za následek razantní snížení počtu nových ohnisek z evropských chovů dobytka. Nové případy vzplanutí slintavky a kulhavky byly i díky dokonalým preventivním opatřením velmi sporadické. Pozornost západních států Evropy se zaměřila na oblast Blízkého Východu, zejména na Turecko, odkud se očekával průnik nových exotických kmenů FMDV. Během let 1962–1987 se v oblasti Turecka a Balkánských států uskutečnilo 30 vakcinačních kampaní sponzorovaných FAO. Při vakcinačním projektu v jihovýchodní Evropě bylo aplikováno 25 miliónů vakcinačních dávek v celkové hodnotě 12 miliónů USD.[29]
V 80. letech byla na žádost komisařů tehdejší EU vypracována analýza, jež měla za cíl porovnat dvě varianty boje proti SLAK: vakcinace zvířat versus bezvakcinační strategie (tzv. bezvakcinační politika). Bezvakcinační politika byla založena na principu velmi důsledné kontroly importů a exportů zvířat a živočišných produktů, úplném zákazu očkování a to i v případě vzniku ohniska, dále pak na razantních opatřeních v případě propuknutí nemoci a její eradikaci metodou stamping-out (tj. utracení všech vnímavých zvířat v ohnisku a v jeho těsné blízkosti).[29] Zavedení bezvakcinační politiky bylo podpořeno několika argumenty. V prvé řadě bylo území Evropské Unie v roce 1989 již 10 let prosté SLAK. Kromě toho z celkového počtu primárních ohnisek potvrzených v Evropě v letech 1977–1987 plných 13 vzniklo buď na základě úniku viru FMDV z laboratoře nebo použitím očkovacích látek s nedostatečně inaktivovaným virem (tzn., že ohnisko vzniklo přímo v důsledku vakcinace).[31] Při rozhodování hrálo důležitou roli i ekonomické hledisko. Podle prognostických odhadů odborníků se v horizontu 10 let předpokládalo v rámci bezvakcinační politiky propuknutí 13 primárních ohnisek, v nejhorším případě až 1 963 ohnisek SLAK v EU. Likvidace těchto ohnisek by přišla na 0,36 miliónů, maximálně na 955 miliónů EUR. Naproti tomu v případě plošné vakcinace v celé EU by náklady činily 1,135 miliardy EUR (pouze náklady za vakcínu).[29] Plošné očkování navíc omezuje obchod (export zvířat a živočišných produktů) se zeměmi, které jsou SLAK prosté a nevakcinují. Finanční ztráty v tomto případě mohou dosahovat až 1,3 biliónů liber ročně.[31] Další důležitou skutečností je neexistence jedné univerzální vakcíny, jež by chránila před všemi kmeny viru slintavky a kulhavky. Z epidemiologického hlediska je významný i fakt, že při infekci očkovaných zvířat vysokou dávkou viru, může docházet u velké části jedinců k vironosičství a permanentnímu vylučování viru do prostředí.[31] Z výše jmenovaných důvodů se proto upustilo od očkování dobytka v EU a bezvakcinační politika byla následně zakomponována do Rozhodnutí komise č. 90/423/EC z 24. června 1990, ve které byl stanoven termín 1. ledna 1992 jakožto datum úplného zákazu vakcinace proti slintavce a kulhavce. Toto usnesení akceptovaly a přijaly za své také všechny tehdy ještě nečlenské země EU včetně České republiky.[29]
Po zavedení bezvakcinační politiky se v Evropě do roku 2000 objevilo pár sporadických ohnisek bez větších následků (viz tabulka). Zlom nastal teprve v roce 2001, kdy Velkou Británii a Západní Evropu postihla obrovská epidemie SLAK. Tato epidemie měla dopad nejen na britské zemědělství, ale dotkla se i běžných občanů Spojeného království a potažmo celé Evropy. Od února 2001 do září 2001 bylo evidováno 2 060 ohnisek, přičemž 2 030 ohnisek se nacházelo na území Velké Británie.[29] Katastrofa měla i sociálně-politickou odezvu. Po zdolání epidemie se opět otevřela mezi odborníky diskuze o boji proti slintavce a zejména o tom, zda vakcinovat či nevakcinovat.
| Rok | Stát | Původ viru | Celkový počet ohnisek |
|---|---|---|---|
| 1991 | Bulharsko | neznámý | 1 |
| 1993 | Itálie | importovaný skot bez certifikátu | 57 |
| 1993 | Bulharsko | neznámý | 1 |
| 1993 | Rusko | únik z laboratoře | 1 |
| 1994 | Řecko | ilegální import ovcí | 95 |
| 1995 | Turecko | ilegální přesun skotu | 1 |
| 1995 | Rusko | import vepřového masa | 1 |
| 1996 | Albánie, Makedonie, Jugoslávie | import nevykostěného masa | 130 |
| 1996 | Turecko | ilegální přesun skotu | 2 |
| 1996 | Řecko | ilegální přistěhovalci | 39 |
| 1996 | Bulharsko | neznámý | 1 |
| 2000 | Řecko | neznámý | 14 |
| 2001 | Velká Británie, Nizozemí, Francie, Irsko | ilegální dovoz masa, přikrmování prasat kuchyňským odpadem | 2060 |
Od roku 2002 až do roku 2008 byla slintavka a kulhavka hlášena pouze z Ruska, Turecka a Velké Británie.[32] Zatímco asijská část Turecka je trvale promořena a každoročně je zde hlášeno více než 100 ohnisek, v případě ohniska nedaleko města Pirbright v Anglii (2007) se jednalo o únik viru z laboratoře a nákaza byla ihned zdolána. Zatímco Velká Británie byla opět zařazena mezi země prosté SLAK, dobytek v Turecku představuje stále velkou hrozbu pro celou Evropu.[29]
Slintavka a kulhavka u lidí
Slintavka a kulhavka je sice považována za zoonózu, nicméně výskyt nemoci u člověka je velmi vzácný.[1] Na celém světě bylo dosud laboratorně potvrzeno a popsáno pouze asi 30 – 40 případů slintavky u člověka, avšak vzhledem k omezeným možnostem diagnostiky v rozvojových zemích s endemickým výskytem SLAK může být skutečný počet nakažených lidí vyšší.[33] První zdokumentovaný případ SLAK u lidí pochází z roku 1834, kdy 3 veterináři zkoušeli dobrovolně infikovat sami sebe. Po čtyři dny pili sklenici nepasterizovaného mléka z nemocných krav. Brzy nato se u nich projevily první klinické příznaky choroby.[34] Poslední publikovaný případ pochází z roku 1966 z Velké Británie, kdy se nakazil jeden muž po požití nepasterizovaného mléka od krávy.[35] Nemoc u lidí nebyla nikdy prokázána z pasterizovaného mléka.[36] Ačkoliv někteří vědci varují před možností mutace viru FMDV a jeho přenosu na člověka,[33] s ohledem na poznatky z historie je riziko přenosu na člověka a vzniku epidemie velmi nízké.[37] Člověk se zdá být vůči viru silně rezistentní. V případě propuknutí infekce u člověka však není známo, zda nemoc probíhá jako následek lokální replikace v místě proniknutí do organismu nebo může vyvolat celkové systémové onemocnění člověka.[37]
SLAK u člověka je nejčastěji způsobena sérotypem O a A, výjimečně sérotypem C. K infekci dochází zřejmě přes oděrky na kůži a sliznici při přímém kontaktu se zvířaty nebo konzumací čerstvého nepasterizovaného mléka.[1] Inkubační doba se pohybuje od 2-6 dní. Hlavními příznaky jsou horečka, bolest v krku, afty v ústní dutině a na jazyku, afty na kůži mezi prsty rukou a nohou. Nedojde-li k bakteriální kontaminaci aft, příznaky vymizí do 1–2 týdnů.[38] Podobná, ale daleko častější onemocnění lidí jsou zapříčiněna příbuznými pikornaviry rodu Enterovirus nebo herpesviry. Zejména u dětí je popsána tzv. nemoc rukou, nohou a úst (z anglického hand, foot and mouth disease), kterou vyvolává virus Coxsackie A nebo enterovirus 71.[1][36] Další nemocí s podobnými příznaky je herpetická gingivostomatitida. Je způsobena herpesvirem HSV-1 a jedná se o vůbec nejčetnější akutní stomatitidu člověka.[39]
Z epidemiologické hlediska je důležitý i fakt, že člověk může přenášet FMDV i uvnitř svého těla a stává se tak zdrojem infekce pro zdravá zvířata.[40] V 70. letech byl izolován virus ze sliznice nosu a hltanu u lidí, kteří nevykazovali příznaky choroby.[41] Následně byl popsán případ přenosu nákazy z prasat na skot prostřednictvím ošetřovatele, u něhož byl virus nalezen v nose a hltanu. Autoři uvádějí životaschopnost viru na sliznicích u člověka až 24 hodin.[42]
Patogeneze
Patogeneze slintavky a kulhavky je nejpodrobněji prozkoumána u skotu a prasat. Vstupní brána infekce do organismu a místo primární replikace viru se může lišit v závislosti na druhu zvířete, typu viru, jeho množství či jeho formě (aerosol či kontaminované krmivo).[8]
Skot se nakazí převážně vdechnutím virového aerosolu.[43] Telata se mohou navíc nakazit při sání mléka od své nemocné matky.[8] Virus, který pronikne do dýchacích cest zvířete, přilne ke sliznici a proniká do buněk sliznice, kde se začíná replikovat. Názory na místo primární replikace FMDV se různí. Zatímco někteří autoři tvrdí, že virus se pomnožuje na sliznici hltanu nebo sliznici plic,[44][45] jiní tvrdí, že k replikaci viru dochází pouze v hltanu a ne v plicích.[46][47] Virus slintavky a kulhavky může proniknout do organismu i skrze oděrky na kůži a sliznicích či přes mikrotraumata na končetinách, respektive paznehtech. Tento způsob infekce je však výjimečný, neboť k infekci přes kůži je potřeba 10000× větší množství viru než inhalační cestou.[43] Po primárním replikaci viru v místě vstupu do organismu přechází virus do krve a dochází tak k tzv. virémii. Krví je virus roznesen do celé řady dalších orgánů. K dalšímu pomnožení viru dochází zejména na těchto místech: ústní dutina, jazyk, hltan, distální části končetin a vemeno.[48] Na místech virem poškozeného epitelu pak vznikají typické vezikuly (také označované jako puchýře) a dochází tak ke klinickému propuknutí nemoci.[2] Puchýře po několika dnech praskají, na jejich místě se objeví afty s krví, které mohou být kontaminovány bakteriemi. Pokud nedojde k bakteriální kontaminaci, začínají se eroze po 2–3 dnech samovolně hojit.[49] Srdeční svalovina je dalším typickým místem pomnožení viru. Zánět srdeční svaloviny (myokarditida) je hlavní příčinou úhynu nemocných mladých, ale někdy i dospělých zvířat.[8] Virus se však pomnožuje i v jiných orgánech, jako je mléčná žláza,[50] slinivka břišní[51] nebo hypotalamus.[52]
Prasata se nakazí nejčastěji perorálně, a to pozřením krmiva kontaminovaného virem nebo přímým kontaktem s nemocným jedincem.[8] Místem primárního pomnožení viru u prasat jsou mandle a sliznice hltanu.[46] Virus slintavky a kulhavky se replikuje na podobných místech jako u skotu, avšak klinicky dominují léze na končetinách (konkrétně na spárcích a paspárcích). Puchýře na jazyku a v ústní dutině se vyskytují v menší míře a jsou často přehlédnutelné.[53]
Klinické příznaky
Inkubační doba SLAK se pohybuje od 2 do 14 dní, přičemž u skotu je to nejčastěji 2–5 dní, u prasat 4–9 dní.[19] Pro ovce a kozy uvádí směrnice EU inkubační dobu 21 dní,[54] přičemž může být samozřejmě kratší. Inkubační doby kolem 21 dnů a více jsou pozorovány v oblastech s endemickým výskytem SLAK nebo v místech, kde se vakcinuje proti SLAK.[19] Morbidita (chorobnost) dosahuje u slintavky až 100 %.[10] Mortalita (úmrtnost) při SLAK u dospělých jedinců je nízká (do 5 %), avšak u selat a jehňat může dosáhnout až 75 %.[19] Zajímavým faktem je, že při epidemii na Tchaj-wanu v roce 1997 byla zaznamenána vysoká úmrtnost u všech věkových kategorií prasat.[8]
Skot
V první fázi nemoci se u zvířat vyvine horečka, která může dosahovat až 41 °C. Během několika hodin po infekci se začnou formovat vezikuly (puchýře) na sliznici v dutině ústní, na jazyku a mulci. Puchýře jsou pro zvířata velmi bolestivé a dochází k výraznému slinění (slinotok), zvířata odmítají přijímat potravu, skřípou zuby, jsou apatická a často ulehají. V případě pastevního chovu se v tuto chvíli nemocné kusy izolují od stáda. Ve stejnou dobu dochází k rapidnímu poklesu tvorby mléka u dojnic. Vezikuly se objevují i mezi prsty a na korunce paznehtu. Bolestivost lézí na paznehtu je příčinou kulhání a neochoty se pohybovat. Nemocné krávy mohou podupávat či vykopávat končetinami. Po dvou až třech dnech vezikuly praskají a na jejich místě se objevují afty s krvavou spodinou.

Ty mohou v případě bakteriální infekce začít hnisat. Po 2 týdnech dochází k samouzdravení, nicméně nemoc může zanechat na zvířeti i trvalé následky, např. v podobě trvalého poklesu dojivosti a hmotnostního přírůstku.[10][19][55] U telat může dojít v důsledku myokarditidy k náhlému úhynu.[8]
Ovce a kozy
U ovcí a koz je průběh podobný jako u skotu, avšak s menší intenzitou.[8] Klinické příznaky se u ovcí a koz objeví 3. den virémie, tzn. v průměru 7 dní po kontaktu s virem. Prvním a dominujícím rysem SLAK u ovcí je kulhání.[56] Nemocné ovce mají horečku, separují se od stáda a vykazují neochotu k pohybu. Vezikuly se objevují na všech částech paznehtu – v meziprstí, v korunkové části atd. Vezikuly se tvoří i v ústní dutině, ale rychle praskají a pokud nedojde k bakteriální kontaminaci, jsou lehce přehlédnutelné. Zhruba u 25 % ovcí se nevyskytnou vezikulární léze vůbec. Při jedné experimentální studii bylo zjištěno, že z celkem 57 infikovaných ovcí, jež měly léze na končetinách, pouze 4 kusy měly puchýře v ústní dutině.[57]
Prasata
Inkubační doba u prasat se sice zpravidla pohybuje v několika dnech (maximálně 14 dní), přesto existují silně virulentní kmeny, u kterých inkubační doba trvá kolem 18 hodin.[53] Příkladem vysoce virulentního kmene je sérotyp O, konkrétně jeho subtyp Cathay, jež byl izolován při epidemii v roce 1997 na Taiwanu.[58] Tento kmen FMDV byl silně patogenní pro prasata, naopak skot jím neonemocní.
V první fázi infekce se dostavují pohybové obtíže, kůže v korunkové oblasti kolem spárků bledne a zvířata vykazují horečku. Teplota může dosahovat až 42 °C. Nemocná prasata se přestávají pohybovat, shlukují se a ulehají bez zájmu o potravu. Na končetinách se objevují první známky zánětu – zarudnutí, bolestivost. Vezikulární léze se objevují především na končetinách – v oblasti korunky spárku, ale i v oblasti paspárku. Někdy může dojít až k úplnému vyzutí rohového pouzdra spárku (latinské označení exungulatio). Tato prasata již nejsou schopna se postavit na končetiny a pohybovat se. Puchýře lze najít rovněž na jazyku a měkkém patře. Prasata rapidně ztrácí hmotnost. Selata do stáří 14 dnů hynou na perakutní myokarditidu.[53]
Patologie
Při pitvě zvířat jsou patognomickým příznakem choroby puchýře (vezikuly) a afty. Puchýře jsou okrouhlého tvaru, vyplněné narůžovělou až červenou tekutinou. V případě bakteriální kontaminace může být obsah zakalený, nažloutlé barvy. Po prasknutí puchýře se vytváří afta. Spodina afty je tvořena výrazně červeně zbarvenou vrstvou stratum papilosum. Afty se nacházejí na sliznici pysků, jazyka a mulce, na neosrstěných místech kůže, na korunce, patkách, mezipaznehtí, vemeni, strucích a vulvě.[49] Puchýřovité léze se mohou nacházet i na sliznici bachoru, čepce a slezu.[59] V případě zhoubného průběhu nemoci se patologické změny lokalizují rovněž na srdci. Myokard je na řezu mozaikovitě černošedé barvy s bělavými pruhy, což vytváří obraz tzv. tygrovitého srdce. Postižena je zejména stěna levé komory a mezikomorová přepážka. Srdeční svalovina je matná, světlejší, hnědožluté barvy a křehké konzistence.[49]
Diagnostika
Slintavka a kulhavka se diagnostikuje na základě klinických příznaků (klinická diagnostika) a potvrzuje se laboratorním vyšetřením (laboratorní diagnostika) na specializovaném pracovišti.[60]
Klinická diagnostika

Klinické projevy SLAK (viz kapitola „klinické příznaky“) jsou detailně známy a mohou se vyskytovat v různé intenzitě. Na základě těchto klinických příznaků lze již vyslovit podezření na výskyt SLAK v chovu. Tyto základní symptomy musí krom veterinárních lékařů znát i chovatelé dobytka, a ti jsou dle české legislativy povinni každé podezření neprodleně hlásit buďto soukromému veterinárnímu lékaři, nebo přímo Krajské veterinární správě.[61] Podezření na výskyt SLAK v chovu skotu lze vyslovit při zjištění kombinace těchto příznaků:
- horečka
- pokles mléčné produkce
- apatie, anorexie, neklid
- nadměrné slinění, skřípaní zubů
- puchýře či afty v dutině ústní, na mulci a na končetinách
- kulhání, podupávání
- aborty
- úhyny telat
Podobnými příznaky se však mohou projevovat i jiná infekční onemocnění, se kterými je nutno počítat a je třeba je rozlišit na základě laboratorního vyšetření. U prasat se identicky projevují zejména vezikulární choroba prasat, vezikulární exantém prasat a vezikulární stomatitida. U skotu, ovcí a koz lze zaměnit SLAK s vezikulární stomatitidou, bovinní virovou diareou (BVD), infekční bovinní rinotracheitidou, katarální horečkou ovcí, morem skotu, neštovicemi ovcí a koz, hlavničkou, stomatitidami jiné etiologie či laminitidou.[19][26][62]
Laboratorní diagnostika
Laboratorní vyšetření provádí pouze specializovaná, státní veterinární správou schválená, akreditovaná laboratoř. Vzorky k vyšetření odebírá pouze soukromý či státní veterinární lékař.[61] V České republice je jedinou schválenou laboratoří pro diagnostiku SLAK pracoviště na Státním veterinárním ústavu v Praze.[63] Světová referenční laboratoř FAO a zároveň referenční laboratoř OIE pro SLAK se nachází v Institute for Animal Health ve městě Pirbright v jižní Anglii.[60] Jako vzorek pro vyšetření na SLAK se odebírá 1 g tkáně z neprasklého nebo čerstvě prasklého puchýře. V některých zemích se odebírá seškrab hltano-jícnové sliznice (tzv. Probang test). Odebraný vzorek tkáně se vkládá do vzorkovnice s transportním médiem, jež představuje roztok glycerolu a 0,04 M fosfátového pufru v poměru 1:1 o pH v rozmezí 7,2–7,4.[60] Přítomnost fosfátového pufru je nezbytná, aby během transportu nedošlo k poklesu pH pod 6,0 a tím k inaktivaci viru.[10] Laboratorní diagnostika se dělí na přímou identifikaci původce a sérologické metody (detekce protilátek). Z metod přímé identifikace se používá nejčastěji komplement fixační test, ELISA nebo izolace viru jeho kultivací na buněčných kulturách.[60] V poslední době se však stále více začíná prosazovat molekulárně-biologická metoda real-time PCR. Pomocí sérologických metod jako je ELISA či virus neutralizační test se provádí pravidelný monitoring dobytka ve státě a zejména preventivní kontroly importovaných či exportovaných zvířat.[64]
Legislativa v ČR ve vztahu k SLAK
Veškerá práva, povinnosti a oprávnění chovatelů, veterinárních lékařů a orgánů státní správy při podezření, vzniku a zdolávání slintavky a kulhavky na území České republiky jsou zakotveny ve veterinárním zákoně č. 166/1999 Sb. ve znění pozdějších předpisů, v novele veterinárního zákona č. 131/2003 Sb. a vyhlášce č. 389/2004 Sb. o opatřeních při tlumení slintavky a kulhavky a proti jejímu předcházení.[61][63] Zde jsou uvedena nejdůležitější fakta z těchto právních norem.
Opatření v případě podezření na výskyt
Slintavka a kulhavka patří do seznamu tzv. nebezpečných nákaz dle OIE a zákona 166/1999, také se označuje jako povinně hlášená nákaza. Ohlašovací povinnost má chovatel, soukromý veterinární lékař a v případě laboratorního potvrzení SLAK má Státní veterinární správa povinnost ohlásit tuto skutečnost všem členským zemím EU. Zároveň je informace o nákaze podána na ústředí OIE. Chovatel je povinen v případě podezření z nákazy zejména izolovat zvířata podezřelá z nákazy, zajistit dezinfekci vchodů a vjezdů do hospodářství, nesmí provádět žádné přesuny zvířat, dále je povinen uskladnit veškeré živočišné produkty a odpady z chovu, sepsat seznam všech zvířat v hospodářství, provést evidenci mléka a zvířat zaslaných na jatka v posledních dnech. Soukromý veterinární lékař by měl do příjezdu úředního veterinárního lékaře předběžně vyšetřit zvířata, poučit chovatele o možných rizicích a odebrat vzorky, hrozí-li prodlení. Příslušná Krajská veterinární správa (dále jen KVS) může nařídit likvidaci mléka, hnoje, úplný zákaz přemisťování zvířat vnímavých i nevnímavých ke SLAK, zákaz vstupu osob do hospodářství, zákaz výjezdu a vjezdu dopravních prostředků do hospodářství. KVS dále zajistí co nejrychlejší transport vzorků do národní referenční laboratoře pro SLAK v Praze, kde musí být stanoven výsledek do 24 hodin od doručení vzorku. Je-li vzorek pozitivní, provede laboratoř opakované vyšetření a zároveň odešle vzorek také do Referenční laboratoře pro EU (Pirbright, Velká Británie).
Opatření v případě potvrzení ohniska nákazy

Bylo-li v hospodářství úředně potvrzeno ohnisko slintavky a kulhavky, nařídí KVS další ochranná a zdolávací opatření: vyhlášení a vymezení ohniska SLAK, ochranného pásma (poloměr nejméně 3 km vzdušnou čarou kolem hospodářství, obvykle celá obec) a pásma dozoru (poloměr nejméně 10 km vzdušnou čarou kolem hospodářství), utracení všech vnímavých zvířat v ohnisku (skot, ovce, kozy, prasata, farmově chovaná spárkatá zvěř), neškodné odstranění všech uhynulých a utracených zvířat dle pohotovostních plánů (nejčastěji spálení), neškodné odstranění všech živočišných produktů (maso, mléko, hnůj) a důsledná dezinfekce a deratizace. Ustájení nových zvířat je možné nejdříve za 21 dní po skončení závěrečné dezinfekce hospodářství. V ochranném pásmu a pásmu dozoru platí rovněž přísná opatření, zejména se sleduje zdravotní stav vnímavých druhů (kontrola teploty a aft), platí zde rovněž omezení přesunů zvířat a nakládání s živočišnými produkty.
KVS musí každých 5 let vypracovávat pohotovostní plán pro případný vznik ohniska nebezpečné nákazy. Účinnost a efektivnost pohotovostních plánů, jakož i koordinace SVS s Armádou a policií ČR při likvidaci nebezpečné nákazy se testuje při pravidelných poplašných cvičeních. Ve výjimečných případech a pouze na základě schválení ústřední nákazové komise může KVS povolit tzv. nouzovou vakcinaci, která se provádí v kruhové pásmu kolem ohniska. Použití nouzové vakcinace však značně prodlužuje lhůtu, kdy může stát získat zpět statut země prosté SLAK bez vakcinace a dochází tak k prodloužení omezení exportu zvířat a živočišných produktů z České republiky.
Podle § 67 veterinárního zákona 166/1999 poskytne stát chovateli finanční náhradu za utracená či poražená zvířata, dezinfekci, deratizaci hospodářství a další výlohy spojené s ochrannými a zdolávacími opatřeními při výskytu slintavky a kulhavky. Podle § 68 se finanční náhrada za utracená nebo nutně poražená zvířata poskytuje ve výši obvyklé ceny zdravého zvířete téhož druhu a kategorie v místě a době vzniku škody.
Terapie a prevence
Léčba slintavky a kulhavky se neprovádí, preventivní očkování je zakázáno.[27] Ve výjimečných případech při vzniku ohniska SLAK a rychlém šíření nákazy může Státní veterinární správa povolit nouzovou vakcinaci kolem ohniska nákazy.[63] Preventivní ochrana státního území před zavlečením SLAK spočívá v přísné kontrole importovaných zvířat a živočišných produktů ze zahraničí. Do ČR lze dovážet zvířata a živočišné produkty pouze ze států, jež mají organizací OIE uznaný statut země prosté SLAK bez vakcinace.
Vakcinace
Očkování proti slintavce a kulhavce je v dnešní době stále hojně diskutovaným tématem, i když v EU platí od roku 1992 zákaz vakcinace.[2] Povolena je pouze nouzová vakcinace při vzniku ohniska SLAK k zabránění dalšího šíření.[63] Tento trend se používá i ve většině ostatních zemích světa, které mají statut zemí prostých SLAK. Na druhou stranu eradikace SLAK v Evropě, v Severní a některých částech Jižní Ameriky je především zásluhou masivních vakcinací během 50.–80. let 20. století.[2]

Historie vzniku prvních vakcín sahá do období těsně před 2. světovou válkou, kdy němečtí vědci začali testovat vakcíny připravené ze sliznic jazyka infikovaného skotu. Německý badatel Waldmann a jeho kolegové izolovali živý virus FMDV, který navázali na adjuvans v podobě hydroxidu hlinitého a virus následně inaktivovali formaldehydem.[65] Problém omezeného zdroje viru a nutnosti experimentálních infekcí zvířat, jenž bránil v masivní produkci vakcín na trh, vyřešil o pár let později nizozemský vědec Frenkel.[2] Ten v roce 1951 poprvé publikoval studii o možnostech kultivace viru slintavky na epiteliálních buňkách hovězího jazyku in vitro.[66] Pomocí této techniky mohla začít výroba vakcín a Nizozemí se tak v roce 1952 stalo první Evropskou zemí, kde se začalo s plošnou vakcinací proti SLAK. K další kvantifikaci při produkci vakcín napomohlo používání buněčných linií.[2]
V současné době je v Evropě a dalších vyspělých zemích přijímán koncept vakcinace pouze v případě vzniku ohniska SLAK jako tzv. nouzová vakcinace. Preventivní plošná vakcinace je zcela odmítána. Z těchto důvodů jsou zřízeny tzv. vakcínové banky pro určitý region. V těchto bankách jsou uschovány antigeny a živé viry velkého množství kmenů FMDV.[8] Vakcínové banky obsahující různé kmeny viru jsou nezbytné z důvodu neexistence jedné universální vakcíny. Mezi 7 sérotypy FMDV není zkřížená reakce a dokonce i mezi subtypy stejného sérotypu může být zkřížená reakce velmi slabá.[19] Z toho plyne, že v případě propuknutí ohniska SLAK musí být použita vakcína proti konkrétnímu subtypu. V případě propuknutí masivní epidemie existují navíc velké obavy, že tyto banky nemohou dodat dostatečné množství vakcín. Mezi další nevýhody vakcinace patří zejména nemožnost rozeznat při sérologickém vyšetření protilátky vzniklé po vakcinaci (postvakcinační) a protilátky vzniklé po proběhlé infekci SLAK (postinfekční). Navíc chráněnost nastupuje za dlouhou dobu (1–3 týdny) po očkování. U zvířat vakcinovaných ale nedostatečně chráněných nemusí být onemocnění klinicky zjevné, avšak mohou vylučovat virus do prostředí. U skotu je rovněž známo trvalé nosičství viru i u vakcinovaných jedinců. Tato fakta a další problémy motivují vědce k dalšímu výzkumu na vakcínách proti SLAK.[8] Byla již publikována řada prací týkajících se nových alternativ pro přípravu vakcín proti SLAK. Jedná se například o podjednotkové vakcíny obsahující pouze rekombinantně[67] nebo synteticky připravený protein VP1.[68][69] Dlouhodobým pasážováním viru na bovinních buněčných liniích nebo kuřecích embryích vznikly živé, oslabené vakcíny, jež sice byly bezpečné, ale nevykazovaly dostatečnou ochranu před virem.[70] Jiné experimenty se zaměřily na použití prázdných virových kapsid FMDV (tzn. virová partikule bez RNA).[71][72][73] Na přelomu tisíciletí přišli američtí vědci s novinkou v tlumení slintavky a kulhavky. Jedná se o použití antivirotik v podobě interferonu (zkratka IFN). Jelikož při nouzové vakcinaci kolem ohniska SLAK jsou vakcinovaná zvířata bezpečně chráněna až po několika dnech, mohou se tato zvířata při rychlém šíření viru nakazit a také vylučovat virus. Právě na tato zdravá, vakcinovaná zvířata by měla být aplikována interferonová léčba.[8] První studie byly provedeny na prasatech, kterým byla aplikována vakcína současně s prasečím interferonem-α (pIFN-α) a hned následující den byla tato prasata vystavena viru slintavky a kulhavky. U všech sledovaných prasat se neobjevily žádné klinické příznaky ani nebyla zjištěna virémie v krvi.[74] V další studii bylo prokázáno, že kombinace vakcíny a pIFN-α chrání bezpečně po dobu 3–5 dní po aplikaci a při použití této kombinace jeden den po kontaktu zvířete s virem výrazně redukuje virémii a snižuje vylučování viru.[75] Nicméně, při testování interferonové terapie u skotu nebylo dosaženo tak uspokojivých výsledků jako u prasat.[76]
Významné epidemie
1997: Tchaj-wan
V březnu roku 1997 se na ostrově Tchaj-wan po 68 letech objevilo ohnisko SLAK u prasat. Vše začalo 14. března 1997, kdy si v jednom z prasečích chovů nedaleko města Hsinchu místní chovatel povšiml puchýřovitých lézí na spárcích prasat. Vzorky odebrané z tohoto chovu byly laboratorně vyšetřeny a 19. března byla potvrzena slintavka a kulhavka sérotypu O.[77] Nemoc se během tří týdnů rozšířila po celém ostrově (zasaženo kolem 6144 chovů[77]) měla zdrcující vliv na průmysl s vepřovým masem a na zemědělství vůbec.[8] Při likvidaci této epidemie uhynulo nebo bylo utraceno více než 4 milióny prasat, což představovalo 38 % celkové populace prasat na Tchaj-wanu.[78] Do doby před propuknutím epidemie patřil Tchaj-wan mezi největší dodavatele vepřového masa do Japonska a v roce 1996 se řadil mezi 15 největších producentů vepřového masa na světě. V letech 1995 až 1996 bylo exportováno z Tchaj-wanu 270 000 tun vepřového masa. Ekonomická ztráta v důsledku poklesu stavu prasat, vakcinace, ztráty pracovních míst a především zákazu exportu vepřového masa do Japonska byla odhadnuta na 6,9 miliard USD.[77]
Kmen viru, který byl původcem epidemie, patří do sérotypu O a je označován jako O/Taw/97. Zvláštností tohoto kmene byla vysoká virulence nejen pro mladé kategorie, ale i pro dospělá prasata. Nákaza byla zdolávána pomocí vakcinace a utracením infikovaných zvířat. Na průběhu epidemie bylo zvláštní to, že ačkoliv se infekce vyskytla ve smíšených chovech, skot ani kozy neonemocněly. Nízká vnímavost viru z Tchaj-wanu vůči skotu byla později potvrzena i experimentálně.[79]
2001: Velká Británie, Nizozemí, Francie a Irsko
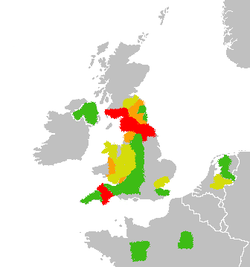
Dnem 20. března 2001, kdy byl u prasat na jatkách v Essexu v Anglii diagnostikován první případ slintavky a kulhavky, vypukla ve Velké Británii epidemie, jež ovlivnila život nejen ve Spojeném království, ale dotkla se přímo či nepřímo celé Evropy.[29] Jednalo se o největší epidemii hospodářských zvířat od konce 2. světové války. Kromě Spojeného království se nemoc rozšířila také do Irska, Francie a Nizozemí.[80] Od 20. března 2001 do 30. září bylo hlášeno celkem 2 060 ohnisek, z čehož 2 030 ohnisek se nacházelo na území Velké Británie.[29] Nejvíce postiženou oblastí bylo hrabství Cumbria v Severozápadní Anglii, kde bylo hlášeno na 893 ohnisek. Vysoké počty ohnisek byly dále zaznamenány v hrabstvích Devon (173), Dumfries & Galloway (176) ve Skotsku, North Yorkshire (133), Durham (85), Northumberland (88) a Powys (70) ve Walesu.[81] Původcem epidemie byl kmen FMDV sérotyp O Pan-Asia, jenž do té doby nebyl v Evropě nikdy přítomen.[82] Příčina, původ ani cesta zavlečení viru na Britské ostrovy nebyla nikdy zjištěna, nicméně za nejpravděpodobnější způsob je označován ilegální dovoz masa či masných produktů z Asie nebo Jižní Afriky a následné zkrmení zbytků z těchto importů prasatům na farmě Burnside v hrabství Northumberland.[13] Ve Spojeném Království bylo v rámci likvidace nákazy utraceno 5,73 miliónu zvířat, z toho bylo 81 % ovcí, 15,3 % skotu, 3,55 % prasat, zanedbatelné procento tvořily kozy, spárkatá zvěř a velbloudovití.[2] Celkové finanční ztráty se odhadují mezi 12,3–13,8 miliardami USD, z čehož přibližně 36 % jsou ztráty v turismu. Jako kompenzaci škod vyplatila britská vláda zemědělcům kolem 4,2 miliardy USD.[83] V žádné z postižených zemí kromě Nizozemí nebylo použito vakcinace a nákaza se likvidovala metodou stamping out. V Nizozemí vláda odsouhlasila vzhledem k obrovské hustotě chovaného dobytka supresivní vakcinaci zdravých zvířat v okolí ohnisek. Tato zdravá, vakcinovaná zvířata byla následně zlikvidována.[84] Díky těmto opatřením se Holanďané brzy s nákazou vypořádali a již 16. června 2001 získali zpět statut země prosté SLAK bez vakcinace. Vybíjení zdravých vakcinovaných zvířat však vyvolalo v Nizozemí velký odpor zemědělců a celé veřejnosti. Negativní reakce veřejnosti pak dovedla OIE ke změnám v boji proti SLAK.[2]
Ekonomicko-sociální vliv

Vliv slintavky a kulhavky na ekonomiku je evidentní. Důkazem toho byla epidemie SLAK v roce 2001 ve Velké Británii. Celkové ztráty nejsou způsobeny jen likvidací obrovských počtů zvířat a náklady spojenými s likvidací nákazy, ale také zákazem exportu živých zvířat, všech živočišných potravin a produktů a omezením cestovního ruchu. Britská vláda odhaduje ztráty v zemědělství a potravinářském průmyslu spojené s událostmi v roce 2001 na 3,1 miliardy liber. Dalších 2,7 až 3,2 miliardy liber si vyžádalo omezení cestovního ruchu v postižených oblastech.[83] Epidemie v Evropě v roce 2001 měla i značný dopad na psychiku lidí a mezi širokou veřejností vyvolalo hromadné vybíjení statisíců kusů dobytka negativní emoce. Nejvíce postiženou skupinou lidí byli samozřejmě chovatelé, ale i lidé žijící na venkově a lidé, kteří se účastnili likvidace nákazy. Ve Velké Británii a v Nizozemí byly evidovány u značného počtu postižených chovatelů příznaky posttraumatického stresu.[85][86] Noční můry, nespavost, deprese, bolení hlavy byly hlavními symptomy této psychické poruhy. Postižení chovatelé v dotaznících rovněž uváděli pocity strachu, obavy ze sociální izolace a nedůvěru ve státní moc.[85] Nizozemští autoři dokládají, že téměř polovina chovatelů, kterých se dotklo vybíjení dobytka, vykazovala příznaky posttraumatického stresu vyžadující lékařkou pomoc.[86] Silný vliv vybíjení zvířat při epidemiích slintavky na psychiku lidí je znám i z historie. Například při epidemii SLAK v Mexiku v letech 1946–1947 bylo nespokojenými chovateli zabito několik veterinářů a státních úředníků, jež se podíleli na likvidaci nákazy.[2]
Ohlas v médiích

Slintavka a kulhavka ve Velké Británii v roce 2001 si získala velkou pozornost médií a rozpoutala diskuzi mezi širokou veřejností po celé Evropě. V médiích se během roku 2001 objevila řada spekulací o příčinách epidemie, na internetu vznikly diskuzní fóra, byly zveřejněny rozhovory s odborníky a publikovány články zaměřené na SLAK. Také však bylo zveřejněno množství neověřených spekulací. Některé webové stránky spekulovaly o tom, že za vznikem epidemie stojí Britská vláda s cílem zlikvidovat chovatele dobytka.[87] Jiné zase uváděly události ve Velké Británii do souvislosti s teroristickými útoky z 11. září 2001 a za viníky zavlečení viru považovaly Al-Kajdu.[88] Jedním z argumentů zastánců konspirační teorie byla zpráva, že pár dní před propuknutím epidemie se údajně ztratila zkumavka s virem slintavky a kulhavky ze státní laboratoře ve městě Porton Down.[89] Tato zpráva však byla brzy vyvrácena a ukázalo se, že jedinou laboratoří, kde se pracuje s virem slintavky a kulhavky, je Institute for Animal Health v Pirbright.[81] Rovněž informace deníku Sunday Express o tom, že státy USA, Kanada a Mexiko provedly 3 měsíce před epidemií v Západní Evropě poplašné cvičení zaměřené na likvidaci SLAK v Texasu, protože byly předem informovány o potenciálním bioteroristickém útoku,[90] se ukázaly jako falešné.[81]
Hlavním rysem internetových diskuzí a publikovaných názorů různých lidí byla silná kritika Britské vlády a tehdejšího premiéra Tonyho Blaira za postup během epidemie. V názorech Britů v internetových debatách byl zjevný nesouhlas s vybíjením zdravých kusů dobytka v okolí ohnisek a nepochopení zákazu vakcinace.[91][92]
Odkazy
Reference
- ↑ a b c d e Smělá G., Vaculín Š. Představuje slintavka a kulhavka nebezpečí pro člověka?. Veterinární lékař. 2007, roč. 5, čís. 3, s. 91–94.
- ↑ a b c d e f g h i j k l m Sutmoller P., Barteling S. S., Olascoaga R. C., Sumption K.J. Control and eradication of foot-and-mouth disease. Virus Res. 2003, roč. 91, čís. 1, s. 101–144. PMID 12527440.
- ↑ Loeffler F., Frosch P. Summarischer Bericht ueber der Ergebnisse der Untersuchungen zur Erforschung der Maul- und Klauenseuche. ZentBl Bakt Parasitenkunde. 1897, roč. 22, s. 257–259.
- ↑ Loeffler F., Frosch P. Report of the commission for research on foot-and-mouth disease. Zentrabl Bacteriol Parasitenkunde Infektionkrankh. 1898, roč. 23, s. 371–391.
- ↑ a b c Brown F. The history of research in foot-and-mouth disease. Virus Res. 2003, roč. 91, čís. 1, s. 3–7. PMID 12527434.
- ↑ Waldmann O., Pape J. Die Kuenstliche Uebertragung der Maul- und Klauenseuche auf das Meerschweinchen. Berl Tierarztl Wschr. 1920, roč. 36, s. 519–520.
- ↑ a b c Vallée H., Carré H. Sur la pluralite du virus aphteux. C R Hebd Acad Sci Paris. 1922, roč. 174, s. 1498–1500.
- ↑ a b c d e f g h i j k l m n o Grubman M. J., Baxt B. Foot-and-mouth disease. Clin Microbiol Rev. 2004, roč. 17, čís. 2, s. 465–93. Dostupné online. PMID 15084510.
- ↑ a b Bachrach H. L. Foot-and-mouth disease. Annu Rev Microbiol. 1968, roč. 22, s. 201–44. PMID 4301615.
- ↑ a b c d e f g h i j VAŘEJKA, F.; MRÁZ, O.; SMOLA, J. Speciální veterinární mikrobiologie. Praha: SPN, 1989. 258 s.
- ↑ Waldmann O., Trautwein K. Experimentelle untersuchen überdie pluralität des maul-und-klauenseuche virus. Berl Tierärtzl Wschr. 1926, roč. 42, s. 569.
- ↑ a b c Brooksby J. B. The virus of foot-and-mouth disease. Adv Virus Res. 1958, roč. 5, s. 1–37. PMID 13508401.
- ↑ a b c d e f Spratt B. G. Independent Review of the safety of UK facilities handling foot-and-mouth disease virus [online]. DEFRA, U. K., 2007-08-31 [cit. 2008-10-10]. Dostupné v archivu pořízeném dne 2007-09-27. (anglicky)
- ↑ a b c d e f g Foot and mouth disease [online]. [cit. 2008-10-10]. Dostupné v archivu pořízeném dne 2008-10-18. (anglicky)
- ↑ Thomson G. R., Vosloo W., Bastos A. D. Foot and mouth disease in wildlife. Virus Res. 2003, roč. 91, čís. 1, s. 145–161. PMID 12527441.
- ↑ Young E., Hedger R. S., Howell P. G. Clinical foot-and-mouth disease in the African buffalo (Syncerus caffer). Onderstepoort J Vet Res. 1972, roč. 39, čís. 3, s. 181–183. PMID 4352040.
- ↑ Anderson E. C., Doughty W. J., Anderson J., Paling R. The pathogenesis of foot-and-mouth disease in the African buffalo (Syncerus caffer) and the role of this species in the epidemiology of the disease in Kenya. J Comp Pathol. 1979, roč. 89, čís. 4, s. 541–549. PMID 232107.
- ↑ Pyakural S., Singh U., Singh N. B. An outbreak of foot-and-mouth disease in Indian elephants (Ellphas maximus). Vet Rec. 1976, roč. 99, čís. 2, s. 28–29. PMID 951925.
- ↑ a b c d e f g h i j k l Foot-and-mouth disease (Hazard Specific Plan) [online]. Canadian Food Inspection Agency [cit. 2008-10-18]. Dostupné online. (anglicky)
- ↑ Böhm M., White P. C., Chambers J., Smith L., Hutchings M. R. Wild deer as a source of infection for livestock and humans in the UK. Vet J. 2007, roč. 174, čís. 2, s. 260–276. PMID 17258479.
- ↑ Gibbs E. P., Herniman K. A., Lawman M. J., Sellers R. F. Foot-and-mouth disease in British deer: transmission of virus to cattle, sheep and deer. Vet Rec. 1975, roč. 96, čís. 26, s. 558–563. PMID 167503.
- ↑ Thrusfield M., Fletcher J. Epidemiological concerns posed by deer during the 2001 British foot and mouth disease outbreak. Deer. 2002, roč. 12, s. 169–171.
- ↑ Sellers R. F. Transmission of viruses by artificial breeding techniques: a review. J R Soc Med. 1983, roč. 76, čís. 9, s. 772–775. Dostupné online. PMID 6312040.
- ↑ Sutmoller P., McVicar J. W., Cottral G. E. The epizootiological importance of foot-and-mouth disease carriers. I. Experimentally produced foot-and-mouth disease carriers in susceptible and immune cattle. Arch Gesamte Virusforsch. 1968, roč. 23, čís. 3, s. 227–235. PMID 5680590.
- ↑ Condy J. B., Hedger R. S., Hamblin C., Barnett I.T. The duration of the foot-and-mouth disease virus carrier state in African buffalo (i) in the individual animal and (ii) in a free-living herd. Comp Immunol Microbiol Infect Dis. 1985, roč. 8, čís. 3–4, s. 259–265. PMID 3004803.
- ↑ a b Foot and mouth disease [online]. Iowa: Iowa State University, rev. 2007-06-01 [cit. 2008-10-22]. Dostupné online. (anglicky)
- ↑ a b OIE - Terrestrial Animal Health Code: Chapter 8.5. [online]. OIE, rev. 2008 [cit. 2008-10-21]. Dostupné v archivu pořízeném dne 2008-11-22. (anglicky)
- ↑ Slintavka a kulhavka z Turecka by nás neměla ohrozit [online]. [cit. 2008-10-28]. Dostupné online.
- ↑ a b c d e f g h i j k Leforban Y., Gerbier G. Review of the status of foot and mouth disease and approach to control/eradication in Europe and Central Asia. Rev Sci Tech. 2002, roč. 21, čís. 3, s. 477–492. PMID 12523688.
- ↑ Fogedby R. Review of epizootiology and control of foot-and-mouth disease in Europe, 1937–1961. Rome: Eur. Comm. Control of FMD, FAO, 1963.
- ↑ a b c Dubanský V., Drábek J. Jak a proč došlo k rozšíření SLAK ve Velké Británii a v Evropě?. Veterinářství. 2001, roč. 51, čís. 5, s. 231–238.
- ↑ WAHID Interface: Detailed countries disease incidence [online]. [cit. 2008-10-22]. Dostupné v archivu pořízeném dne 2008-02-07. (anglicky)
- ↑ a b Mayor S. UK investigates possible human cases of foot and mouth disease. BMJ. 2001, roč. 322, čís. 7294, s. 1085. Dostupné online. PMID 11337433.
- ↑ Hertwig C. A. Übertragung tierischer Ansteckungsstoffe auf den Menschen. Med Vet Z. 1834, roč. 48.
- ↑ Armstrong R., Davie J., Hedger R. S. Footandmouth disease in man. BMJ. 1967, roč. 4, čís. 5578, s. 529–530. Dostupné online. PMID 4294412.
- ↑ a b Prempeh H., Smith R., Müller B. Foot and mouth disease: the human consequences. The health consequences are slight, the economic ones huge. BMJ. 2001, roč. 322, čís. 7286, s. 565–566. Dostupné online. PMID 11238137.
- ↑ a b Brown D. W. G. Foot and mouth disease in human beings. Lancet. 2001, roč. 357, čís. 9267, s. 1463. PMID 11377592.
- ↑ Bauer K. Foot- and-mouth disease as zoonosis. Arch Virol. 1997, roč. 13, s. 95–97. PMID 9413529.
- ↑ Holbrook W. P., Gudmundsson G. T., Ragnarsson K. T. Herpetic gingivostomatitis in otherwise healthy adolescents and young adults. Acta Odontol Scand. 2001, roč. 59, čís. 3, s. 113–115. PMID 11501877.
- ↑ Donaldson A. I., Sellers R. F. Transmission of FMD by people. Vet Rec. 2003, roč. 153, čís. 9, s. 279–280. PMID 12974344.
- ↑ Sellers R. F., Donaldson A. I., Herniman K. A. Transfer of foot and mouth disease virus by man. J Hyg Camb. 1971, roč. 68, s. 565–573.
- ↑ Sellers R. F., Herniman K. A., Mann J. A. Transfer of foot-and-mouth disease virus in the nose of man from infected to non-infected animals. Vet Rec. 1971, roč. 89, čís. 16, s. 447–449. PMID 4332392.
- ↑ a b Donaldson A. I. Foot-and-mouth disease: the principal features. Vet J. 1987, roč. 41, s. 325–327.
- ↑ Brown C. C., Meyer R. F., Olander H. J., House C., Mebus C. A. A pathogenesis study of foot-and-mouth disease in cattle, using in situ hybridization. Can J Vet Res. 1992, roč. 56, čís. 3, s. 189–193. Dostupné online. PMID 1330277.
- ↑ Sutmoller P., McVicar J. W. Pathogenesis of foot-and-mouth disease: the lung as an additional portal of entry of the virus. J Hyg (London). 1976, roč. 77, čís. 2, s. 235–243. PMID 185288.
- ↑ a b Burrows R., Mann J. A., Garland A. J., Greig A., Goodridge D. The pathogenesis of natural and simulated natural foot-and-mouth disease infection in cattle. J Comp Pathol. 1981, roč. 91, čís. 4, s. 599–609. PMID 6274930.
- ↑ Zhang Z. D., Kitching R. P. The localization of persistent foot and mouth disease virus in the epithelial cells of the soft palate and pharynx. J Comp Pathol. 2001, roč. 124, čís. 2–3, s. 89–94. PMID 11222004.
- ↑ Graves J. H., McVicar J. W., Sutmoller P., Trautman R. Contact transmission of foot-and-mouth disease from infected to susceptible cattle. J Infect Dis. 1971, roč. 123, čís. 4, s. 386–391. PMID 4329344.
- ↑ a b c ŠTĚRBA O. Virové choroby spárkaté zvěře. Brno: VFU Brno, 1997.
- ↑ Burrows R. Excretion of foot-and-mouth disease virus prior to the development of lesions. Vet Rec. 1968, roč. 82, s. 387–388.
- ↑ Manocchio M. Selective necrosis of the islets of Langerhans in a cow with experimental foot and mouth disease. Veterinaria. 1974, roč. 50, čís. 1–3, s. 182.
- ↑ Scott F. W., Cottral G. E., Gailiunas P. Presence of foot-andmouth disease virus in the pituitary and central nervous system of experimentally infected cattle. Proceedings of the 69th Annual Mtg US Livestock Sanitary Assoc. 1965.
- ↑ a b c Kitching P., Alexandersen S. Clinical variation in foot-and-mouth disease: pigs. Rev Sci Tech Off Int Epizoot. 2002, roč. 21, čís. 3, s. 513–518. PMID 12523692.
- ↑ Council Directive 2003/85/EC [online]. EU [cit. 2008-10-19]. Dostupné online. (anglicky)[nedostupný zdroj]
- ↑ DEFRA, UK; Disease factsheet: Foot-and-mouth disease [online]. [cit. 2008-10-19]. Dostupné v archivu pořízeném dne 2008-10-23. (anglicky)
- ↑ Kitching R. P., Hughes G. J. Clinical variation in foot and mouth disease: sheep and goats. Rev Sci Tech Off Int Epizoot. 2002, roč. 21, čís. 3, s. 505–512. PMID 12523691.
- ↑ Hughes G. J., Mioulet V., Kitching R. P., Haydon D. T., Woolhouse M. E., Alexandersen S., Donaldson A. I. Foot and mouth disease virus infection of sheep: implications for diagnosis and control. Vet Rec. 2002, roč. 150, s. 724–727.
- ↑ Samuel A. R., Knowles N. J. Foot-and-mouth disease type O viruses exhibit genetically and geographically distinct evolutionary lineages (topotypes). J Gen Virol. 2001, roč. 82, čís. 3, s. 609–621. PMID 11172103.
- ↑ Kitching R. P. Clinical variation in foot and mouth disease: cattle. Rev Sci Tech. 2002, roč. 21, čís. 3, s. 499–504. PMID 12523690.
- ↑ a b c d OIE Terrestrial diagnostic manual: Foot and mouth disease [online]. OIE, rev. 2008-07-17 [cit. 2008-10-20]. Dostupné v archivu pořízeném dne 2008-12-09. (anglicky)
- ↑ a b c Zákon č. 166/1999 Sb. [online]. [cit. 2008-10-20]. Dostupné online.[nedostupný zdroj]
- ↑ APHIS. Foot and mouth disease [online]. The U.S. Department of Agriculture (USDA), APHIS, rev. 2007-02-01 [cit. 2008-10-22]. Dostupné v archivu pořízeném dne 2008-11-12. (anglicky)
- ↑ a b c d Vyhláška 389/2004 Sb. [online]. Ministerstvo vnitra ČR [cit. 2008-10-20]. Dostupné v archivu pořízeném dne 2010-02-16.
- ↑ Informační bulletin 10/99: Slintavka a kulhavka a vezikulární choroby v ČR v letech 1996-1998 [online]. Praha: SVS ČR [cit. 2008-10-20]. Dostupné online.[nedostupný zdroj]
- ↑ Waldmann O., Pyl G., Hobohm K. O., Mohlmann H. Die Entwicklung des Riemser Adsorbatimpfstoffes gegen Maul-und Klauenseuche und seine Herstellung. Zbl. Bakt. I. Orig. 1941, roč. 148, s. 1.
- ↑ Frenkel H. S. Research on foot-and-mouth disease. II. The cultivation of the virus on a practical scale in explantations of bovine tongue epithelium. Am J Vet Res. 1951, roč. 12, s. 187.
- ↑ Kleid D. G., Yansura D., Small B., Dowbenko D., Moore D. M., Grubman M. J., McKercher P. D., Morgan D. O., Robertson B. H., Bachrach H. L. Cloned viral protein vaccine for foot-and-mouth disease: responses in cattle and swine. Science. 1981, roč. 214, čís. 4525, s. 1125–1129. PMID 6272395.
- ↑ Francis M. J., Hastings G. Z., Brown F., McDermed J., Lu Y. A., Tam J. P. Immunological evaluation of the multiple antigen peptide (MAP) system using the major immunogenic site of foot-and-mouth disease virus. Immunology. 1991, roč. 73, čís. 3, s. 249–254. PMID 1652552.
- ↑ Nargi F., Kramer E., Mezencio J., Zamparo J., Whetstone C., Van Regenmortel M. H., Briand J. P., Muller S., Brown F. Protection of swine from foot-and-mouth disease with one dose of an all-D retro peptide. Vaccine. 1999, roč. 17, čís. 22, s. 2888–2893. PMID 10438060.
- ↑ Brooksby J. B. Portraits of viruses: foot-and-mouth disease virus. Intervirology. 1982, roč. 18, čís. 1–2, s. 1–23. PMID 6288615.
- ↑ Grubman M. J., Robertson B. H., Morgan D. O., Moore D. M., Dowbenko D. Biochemical map of polypeptides specified by foot-and-mouth disease virus. J Virol. 1984, roč. 50, čís. 2, s. 579–586. PMID 6323757.
- ↑ Roosien J., Belsham G. J., Ryan M. D., King A. M., Vlak J. M. Synthesis of foot-and-mouth disease virus capsid proteins in insect cells using baculovirus expression vectors. J Gen Virol. 1990, roč. 71, s. 1703–1711. PMID 2167924.
- ↑ Lewis S. A., Morgan D. O., Grubman M. J. Expression, processing, and assembly of foot-and-mouth disease virus capsid structures in heterologous systems: induction of a neutralizing antibody response in guinea pigs. J Virol. 1991, roč. 65, čís. 12, s. 6572–6580. PMID 1658362.
- ↑ Chinsangaram J., Moraes M. P., Koster M., Grubman M. J. Novel viral disease control strategy: adenovirus expressing alpha interferon rapidly protects swine from foot-and-mouth disease. J Virol. 2003, roč. 77, čís. 2, s. 1621–1625. Dostupné online. PMID 12502879.
- ↑ Moraes M. P., Chinsangaram J., Brum M. C., Grubman M. J. Immediate protection of swine from foot-and-mouth disease: a combination of adenoviruses expressing interferon alpha and a foot-and-mouth disease virus subunit vaccine. Vaccine. 2003, roč. 22, čís. 2, s. 268–279. PMID 14615155.
- ↑ Wu Q., Brum M. C., Caron L., Koster M., Grubman M. J. Adenovirus-mediated type I interferon expression delays and reduces disease signs in cattle challenged with foot-and-mouth disease virus. J Interferon Cytokine Res. 2003, roč. 23, čís. 7, s. 359–368. PMID 14511462.
- ↑ a b c USDA. USDA: Foreign Animal Disease Report, 1998 [online]. USDA [cit. 2008-10-27]. Dostupné v archivu pořízeném dne 2007-02-02. (anglicky)
- ↑ Yang P. C., Chu R. M., Chung W. B., Sung H. T. Epidemiological characteristics and financial costs of the 1997 foot-and-mouth disease epidemic in Taiwan. Vet Rec. 1999, roč. 145, čís. 25, s. 731–734. PMID 10972111.
- ↑ Dunn C. S., Donaldson A. I. Natural adaption to pigs of a Taiwanese isolate of foot-and-mouth disease virus. Vet Rec. 1997, roč. 141, čís. 7, s. 174–175. PMID 9290197.
- ↑ Scudamore J. M., Harris D. M. Control of foot and mouth disease: lessons from the experience of the outbreak in Great Britain in 2001. Rev Sci Tech. 2002, roč. 21, čís. 3, s. 699–710. Dostupné v archivu pořízeném dne 2003-08-24. PMID 12523708.
- ↑ a b c Scudamore J. M. Origin of the UK Foot and Mouth Disease epidemic in 2001 [online]. DEFRA, UK, rev. 2002-06-01 [cit. 2008-11-19]. Dostupné v archivu pořízeném dne 2008-02-16. (anglicky)
- ↑ Knowles N. J., Samuel A. R., Davies P. R., Kitching R. P., Donaldson A. I. Outbreak of foot-and-mouth disease virus serotype O in the UK caused by a pandemic strain. Vet Rec. 2001, roč. 148, čís. 9, s. 258–259. PMID 11292084.
- ↑ a b Thompson D., Muriel P., Russell D., Osborne P., Bromley A., Rowland M., Creigh-Tyte S., Brown C. Economic costs of the foot and mouth disease outbreak in the United Kingdom in 2001. Rev Sci Tech. 2002, roč. 21, čís. 3, s. 675–687. Dostupné v archivu pořízeném dne 2006-09-27. PMID 12523706.
- ↑ Pluimers F. H., Akkerman A. M., van der Wal P., Dekker A., Bianchi A. Lessons from the foot and mouth disease outbreak in The Netherlands in 2001. Rev Sci Tech. 2002, roč. 21, čís. 3, s. 711–21. Dostupné v archivu pořízeném dne 2007-03-03. PMID 12523709.
- ↑ a b Mort M., Convery I., Baxter J., Bailey C. Psychosocial effects of the 2001 UK foot and mouth disease epidemic in a rural population: qualitative diary based study. BMJ. 2005, roč. 331, čís. 7527, s. 1234. Dostupné online. PMID 16214809.
- ↑ a b Olff M., Koeter M. W., Van Haaften E. H., Kersten P. H., Gersons B. P. Impact of a foot and mouth disease crisis on post-traumatic stress symptoms in farmers. Br J Psychiatry. 2005, roč. 186, s. 165–166. Dostupné online. PMID 15684242.
- ↑ Slintavka a kulhavka - spekulace OSUDU.cz z před 6 let, že může jít o teroristický akt britské vlády, se potvrzují [online]. [cit. 2008-12-12]. Dostupné online.[nedostupný zdroj]
- ↑ Bioteroristé útočili možná první [online]. [cit. 2008-12-12]. Dostupné online.
- ↑ Stolen foot-and-mouth virus 'released deliberately' [online]. [cit. 2008-12-12]. Dostupné v archivu pořízeném dne 2008-10-17. (anglicky)
- ↑ NYDP: US held foot and mouth simulation 3 months before UK Outbreak [online]. [cit. 2008-12-12]. Dostupné online. (anglicky)
- ↑ A conspiracy to kill off the countryside [online]. [cit. 2008-12-12]. Dostupné online. (anglicky)
- ↑ 'You're not killing my animals!' Refuge owner battles UK government over slaughter policy [online]. [cit. 2008-12-12]. Dostupné online. (anglicky)
Literatura
- Česky
- VAŘEJKA, F.; MRÁZ, O.; SMOLA, J. Speciální veterinární mikrobiologie. Praha: SPN, 1989. 258 s.
- Smělá G., Vaculín Š. Představuje slintavka a kulhavka nebezpečí pro člověka?. Veterinární lékař. 2007, roč. 5, čís. 3, s. 91–94. Dostupné online.[nedostupný zdroj]
- Anglicky
- Grubman M. J., Baxt B. Foot-and-mouth disease. Clin Microbiol Rev. 2004, roč. 17, čís. 2, s. 465–93. Dostupné online. PMID 15084510.
- Sutmoller P., Barteling S. S., Olascoaga R. C., Sumption K.J. Control and eradication of foot-and-mouth disease. Virus Res. 2003, roč. 91, čís. 1, s. 101–144. PMID 12527440.
Externí odkazy
 Obrázky, zvuky či videa k tématu Slintavka a kulhavka na Wikimedia Commons
Obrázky, zvuky či videa k tématu Slintavka a kulhavka na Wikimedia Commons - (anglicky) OIE: Foot-and-mouth disease website
- (anglicky) DEFRA, UK: Foot and Mouth Disease Control Strategy for Great Britain
- (anglicky) DEFRA, UK: Fotodokumentace klinických příznaků u skotu
- (anglicky) DEFRA, UK: Fotodokumentace klinických příznaků u ovcí
- (anglicky) DEFRA, UK: Fotodokumentace klinických příznaků u prasat
